-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g),K2 △H2<0 (Ⅱ)
2ClNO(g),K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3mol·L﹣1·min﹣1,则平衡后n(Cl2)= mol,NO的转化率α1= .其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”“不变”).若要使K2减小,可采取的措是 .
-
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
则4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,NO的转化率α1=_______。其他条件保持不变,若反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”、“<”或“=”)。
(3)汽车使用乙醇汽油可减少石油的消耗,并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 ,已知常温下NO2-的水解常数Kh=2×10-11 mol•L-1。 常温下某NaNO2和HNO2混合溶液的pH=5,则混合溶液中c(NO2-)和c(HNO2)的比值为_________。
(4)利用右图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为_______________。在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为___________________。

(5)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的Ksp=5.48×10-7,饱和亚硫酸中c(SO32-) =6.3×10-8 mol•L-1。将0.1 mol •L-1的BaCl2溶液滴入饱和亚硫酸中,_____(填“能”、“不能”)生成BaSO3沉淀,原因是_______________________________(写出推断过程)。
-
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
则4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,NO的转化率α1=_______。其他条件保持不变,若反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”、“<”或“=”)。
(3)汽车使用乙醇汽油可减少石油的消耗,并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 ,已知常温下NO2-的水解常数Kh=2×10-11 mol•L-1。 常温下某NaNO2和HNO2混合溶液的pH=5,则混合溶液中c(NO2-)和c(HNO2)的比值为_________。
(4)利用右图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为_______________。在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为___________________。
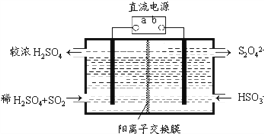
(5)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的Ksp=5.48×10-7,饱和亚硫酸中c(SO32-) =6.3×10-8 mol•L-1。将0.1 mol •L-1的BaCl2溶液滴入饱和亚硫酸中,_____(填“能”、“不能”)生成BaSO3沉淀,原因是_______________________________(写出推断过程)。
-
(15分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H =a kJ/mol (I)
NaNO3(s)+ClNO(g) K1 ∆H =a kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H =b kJ/mol (II)
2ClNO(g) K2 ∆H =b kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后
n(Cl2)= mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数K2 (填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
-
(17分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g) 2NOCl(g) K2 △H2<0 (Ⅱ)
2NOCl(g) K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1molCl2,10min时反应(Ⅱ)达到平衡。测得10min内v(NOCl)=7.5×10-3mol/(L•min),则平衡后n(Cl2)=______ mol,NO的转化率α1=______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2______α1(填“>”“<”或“=”),平衡常数K2_____(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是______。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________。(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。
(4)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)+Q1 K1 (Ⅰ)
2NO(g)+Cl2(g)⇌2ClNO(g)+Q2 K2 (Ⅱ)
(1)4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用含K1、K2的代数式表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡.测得在10min内v(ClNO)=7.5×10﹣3mol•L﹣1•min﹣1,则平衡后n(Cl2)=_____mol,NO的转化率а1=____.其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率а2____а1(填“>”“<”或“=”),平衡常数K2____(填“增大”“减小”或“不变”).若要使K2减小,可采用的措施是____.
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L﹣1的CH3COONa溶液,则两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为____.(已知HNO2的电离常数Ka=7.1×10﹣4mol•L﹣1,CH3COOH的电离常数Ka=1.7×10﹣5mol•L﹣1,可使溶液A和溶液B的pH相等的方法是____.
a 向溶液A中加适量水 b 向溶液A中加适量NaOH
c 向溶液B中加适量水 d 溶液B中加适量NaOH.
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)+Q1 K1 (Ⅰ)
2NO(g)+Cl2(g)⇌2ClNO(g)+Q2 K2 (Ⅱ)
(1)4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用含K1、K2的代数式表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡.测得在10min内v(ClNO)=7.5×10﹣3mol•L﹣1•min﹣1,则平衡后n(Cl2)=_____mol,NO的转化率а1=____.其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率а2____а1(填“>”“<”或“=”),平衡常数K2____(填“增大”“减小”或“不变”).若要使K2减小,可采用的措施是____.
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L﹣1的CH3COONa溶液,则两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为____.(已知HNO2的电离常数Ka=7.1×10﹣4mol•L﹣1,CH3COOH的电离常数Ka=1.7×10﹣5mol•L﹣1,可使溶液A和溶液B的pH相等的方法是____.
a 向溶液A中加适量水 b 向溶液A中加适量NaOH
c 向溶液B中加适量水 d 溶液B中加适量NaOH.
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____________(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=___________mol,NO的转化率а1=________。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2_________а1(填“>”“<”或“=”),平衡常数K2_________(填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是_______________________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、 和c(CH3COO‾)由大到小的顺序为____________________。(已知HNO2的电离常数
和c(CH3COO‾)由大到小的顺序为____________________。(已知HNO2的电离常数 ,CH3COOH的电离常数
,CH3COOH的电离常数 ),可使溶液A和溶液B的pH相等的方法是______________。
),可使溶液A和溶液B的pH相等的方法是______________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=8.0×10-3mol•L-1•min-1,回答下列问题
①平衡后n(Cl2)=__________mol,
②NO的转化率а1=_______。
③其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2________а1(填“>”“<”或“=”),平衡常数K2___________(填“增大”“减小”或“不变”)。
④若要使K2减小,可采用的措施是________________________。
NaNO3(s)+ClNO(g) K1 ∆H =a kJ/mol (I)
2ClNO(g) K2 ∆H =b kJ/mol (II)
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。

