-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,发生如下反应:4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)
完成下列填空:
(1)写出该反应的平衡常数表达式K=______。若只改变一个影响化学平衡的因素,则下列关于平衡常数K与化学平衡移动关系的叙述正确的是______(填序号)。
a.K值不变,平衡不移动
b.K值变化,平衡一定移动
c.平衡移动,K值可能不变
d.平衡移动,K值一定变化
(2)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是_____(填序号)。
a.υ正(NO2)=2υ正(NO)
b.NO和Cl2的物质的量之比不变
c.混合气体密度保持不变
d.c (NO2):c (NO):c (Cl2)=4:2:1
(3)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和适量NaCl固体,10min时反应达到平衡.测得10min内υ(NO2)=0.015mol/(L•min),则平衡后n (Cl2)=______mol,此时NO2的转化率为а1;保持其它条件不变,扩大容器的体积,当反应再次达到平衡时NO2的转化率为а2,则а2_____а1(选填“>”、“<”或“=”)。
实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得到1L溶液A,溶液B为0.1mol/L的CH3COONa溶液。
(4)两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为________________。
(5)可使溶液A和溶液B的pH相等的方法是__________(填序号)。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,发生如下反应:4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)
完成下列填空:
(1)写出该反应的平衡常数表达式K=______。若只改变一个影响化学平衡的因素,则下列关于平衡常数K与化学平衡移动关系的叙述正确的是______(填序号)。
a.K值不变,平衡不移动
b.K值变化,平衡一定移动
c.平衡移动,K值可能不变
d.平衡移动,K值一定变化
(2)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是_____(填序号)。
a.υ正(NO2)=2υ正(NO)
b.NO和Cl2的物质的量之比不变
c.混合气体密度保持不变
d.c (NO2):c (NO):c (Cl2)=4:2:1
(3)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和适量NaCl固体,10min时反应达到平衡.测得10min内υ(NO2)=0.015mol/(L•min),则平衡后n (Cl2)=______mol,此时NO2的转化率为а1;保持其它条件不变,扩大容器的体积,当反应再次达到平衡时NO2的转化率为а2,则а2_____а1(选填“>”、“<”或“=”)。
实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得到1L溶液A,溶液B为0.1mol/L的CH3COONa溶液。
(4)两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为________________。
(5)可使溶液A和溶液B的pH相等的方法是__________(填序号)。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
-
氮氧化物与悬浮在大气中海盐粒子的相互反应:4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)  在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为 。下列叙述中正确的是
。下列叙述中正确的是
A. 10min内NO浓度变化表示的速率υ(NO)=0.01mol·L-1·min-1
B. 若升高温度,平衡逆向移动,则该反应的
C. 若起始时向该容器中充入0.1molNO2(g)、0.2molNO(g)和0.1molCl2(g)(固体物质足量),则反应将向逆反应方向进行
D. 若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率小于
-
氮氧化物与悬浮在大气中海盐粒子的相互反应:
4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+ Cl2(g),ΔH
2NaNO3(s)+2NO(g)+ Cl2(g),ΔH
在恒温条件下,向2 L恒容密闭容器中加入0.4mol NO2和0.2 mol NaCl,10 min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为α。下列叙述中正确的是
A.10min内NO浓度变化表示的速率v(NO)=0.01 mol·L-1·min-1
B.若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于α
C.若升高温度,平衡逆向移动,则该反应的ΔH>0
D.若起始时向容器中充入NO2(g) 0.1 mol、NO(g)0.2 mol和Cl2(g)0.1 mol(固体物质足量),则反应将向逆反应方向进行
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g),K2 △H2<0 (Ⅱ)
2ClNO(g),K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3mol·L﹣1·min﹣1,则平衡后n(Cl2)= mol,NO的转化率α1= .其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”“不变”).若要使K2减小,可采取的措是 .
-
I.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时, 涉及如下反应: 2NO(g) +Cl2(g)  2ClNO(g) ΔH< 0
2ClNO(g) ΔH< 0
写出该反应的平衡常数表达式 。
为研究不同条件对反应的影响,:在恒温条件下, 向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2, 10 min时反应达到平衡。测得10 min内v(ClNO) =7.5×10-3 mol·L-1·min-1, 则平衡后n(Cl2) = mol, NO的转化率α1= 。其他条件保持不变, 反应在恒压条件下进行, 平衡时NO的转化率α2 α1(填“>” “<” 或“=”), 平衡常数K (填“增大” “减小” 或“不变”) 。若要使K减小, 可采取的措施是 。
II. 实验室可用NaOH溶液吸收NO2, 反应为2NO2+2NaOH NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A, 溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为 。
NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A, 溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为 。
(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1, CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是 。
a. 向溶液A中加适量水 b. 向溶液A中加适量NaOH
c. 向溶液B中加适量水 d. 向溶液B中加适量NaOH
III.(1)已知丙醛的燃烧热为 ,丙酮的燃烧热为
,丙酮的燃烧热为 ,试写出丙醛燃烧热的热化学方程式 。
,试写出丙醛燃烧热的热化学方程式 。
(2)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH) 2,装置如右下图所示,其中P端通入CO2。

①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A. X、Y两端都必须用铁作电极 B. 可以用NaOH溶液作为电解液
C. 阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- D. 白色沉淀只能在阳极上产生
-
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
则4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,NO的转化率α1=_______。其他条件保持不变,若反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”、“<”或“=”)。
(3)汽车使用乙醇汽油可减少石油的消耗,并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 ,已知常温下NO2-的水解常数Kh=2×10-11 mol•L-1。 常温下某NaNO2和HNO2混合溶液的pH=5,则混合溶液中c(NO2-)和c(HNO2)的比值为_________。
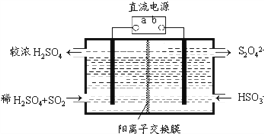
(4)利用右图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为_______________。在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为___________________。

(5)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的Ksp=5.48×10-7,饱和亚硫酸中c(SO32-) =6.3×10-8 mol•L-1。将0.1 mol •L-1的BaCl2溶液滴入饱和亚硫酸中,_____(填“能”、“不能”)生成BaSO3沉淀,原因是_______________________________(写出推断过程)。
-
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
则4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,NO的转化率α1=_______。其他条件保持不变,若反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”、“<”或“=”)。
(3)汽车使用乙醇汽油可减少石油的消耗,并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 ,已知常温下NO2-的水解常数Kh=2×10-11 mol•L-1。 常温下某NaNO2和HNO2混合溶液的pH=5,则混合溶液中c(NO2-)和c(HNO2)的比值为_________。
(4)利用右图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为_______________。在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为___________________。
(5)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的Ksp=5.48×10-7,饱和亚硫酸中c(SO32-) =6.3×10-8 mol•L-1。将0.1 mol •L-1的BaCl2溶液滴入饱和亚硫酸中,_____(填“能”、“不能”)生成BaSO3沉淀,原因是_______________________________(写出推断过程)。
-
(17分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g) 2NOCl(g) K2 △H2<0 (Ⅱ)
2NOCl(g) K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1molCl2,10min时反应(Ⅱ)达到平衡。测得10min内v(NOCl)=7.5×10-3mol/(L•min),则平衡后n(Cl2)=______ mol,NO的转化率α1=______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2______α1(填“>”“<”或“=”),平衡常数K2_____(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是______。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________。(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。
(4)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
2NOCl(g) K2 △H2<0 (Ⅱ)
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。


