-
化学与生活密切相关,下列叙述中不正确的是
A.户外钢架桥生锈主要是电化学腐蚀所致
B.导电塑料是应用于电子工业的一种新型有机高分子材料
C.CO2、NO2或SO2都会导致酸雨的形成
D.葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒
难度: 中等查看答案及解析
-
莽草酸的结构简式如下图所示,可用来合成药物达菲,下列关于莽草酸的说法错误的是
A.分子式为C7H10O5
B.分子中含有两种官能团
C.既可发生加成又可发生取代反应
D.能够使酸性高锰酸钾溶液和溴水褪色
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列结论正确的是
W
X
Y
Z
A.X、Y、Z中最简单氢化物稳定性最弱的是Z
B.Z元素氧化物对应水化物的酸性一定强于Y
C.Z元素单质在化学反应中只表现氧化性
D.X、Y、Z元素形成的单核阴离子还原性最强的是Y
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
①常温常压下,18g14CH4所含中子数目为8 NA
②1L0.1mol·L-1的氨水中有NA个NH4+
③1mol Na2O2中含有NA个阴离子
④1L1mol·L-1NaClO 溶液中含有ClO-的数目为NA
⑤78g 苯含有C=C双键的数目为3NA
⑥0.1molN2和0.3molH2在某密闭容器中充分反应,转移电子的数目为0.6NA
⑦60gSiO2晶体中含有硅氧键的数目为4NA
A.①③⑦ B.②③⑥ C.②④⑥ D.①④⑤⑦
难度: 中等查看答案及解析
-
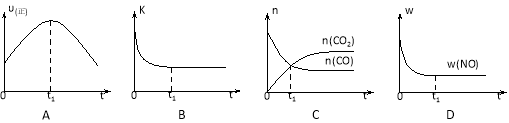
如图表示溶液中c(H+)和c(OH-)的关系,下列判断正确的是

A.图中T1>T2
B.XZ线上任意点均有pH<7
C.两条曲线间任意点均有c(H+)×c(OH-)=Kw
D.M区域内任意点对应的溶液中
下列离子可以大量共存:Fe3+、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
下列关于有机物的叙述正确的是
A.甲苯分子中所有原子均在同一个平面上
B.分子式为C4H9Br的同分异构体共有4种(不考虑立体异构)
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.淀粉、天然油脂、脂肪酶都属于天然高分子化合物
难度: 中等查看答案及解析
-
下列实验操作不能达到实验目的的是
实验目的
实验操作
A
证明乙烯能发生加成反应
将乙烯气体通入溴的四氯化碳溶液中
B
鉴别Fe(OH)3胶体和FeCl3溶液
用激光笔分别照射两种物质,从侧面观察是否出现光亮的通路。
C
检验酒精中是否含有水
取少量酒精加入无水硫酸铜粉末
D
鉴别苯、环已烯和已烷
加入酸性高锰酸钾溶液
难度: 中等查看答案及解析