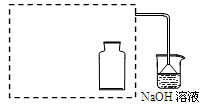
-
次氯酸钠能有效地杀灭水中的细菌和病毒。该过程不可能涉及的变化有
A.置换反应 B.复分解反应 C.电离 D.水解
难度: 简单查看答案及解析
-
化学与生产和生活密切相关,下列说法正确的是
A.金属钠可以保存在煤油或酒精中,防止在空气中变质
B.石油的裂化和煤的干馏,都属于化学变化
C.等物质的量的乙烯和乙醇完全燃烧时所需氧气的质量相等
D.聚氯乙烯制品易造成白色污染,可采用焚烧法处理
难度: 简单查看答案及解析
-
室温下,对于醋酸及其盐的下列判断正确的是
A.稀醋酸溶解石灰石的离子方程式为
CaCO3+2H+=Ca2++H2O+CO2↑
B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大
C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如右图
D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同
难度: 中等查看答案及解析
-
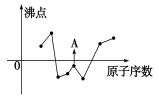
几种短周期元素的原子半径及主要化合价如下表,相关说法正确的是
元素代号
L
M
X
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、-2
+2
-2
A.离子半径大小:r(M3+) >r(T2-) B.其中R的金属性最强
C.煤和石油中存在X元素 D.L、X形成的简单离子核外电子数相等
难度: 中等查看答案及解析
-
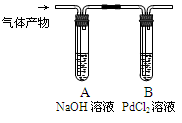
用下列实验装置进行相应实验,装置正确且能达到实验目的的是
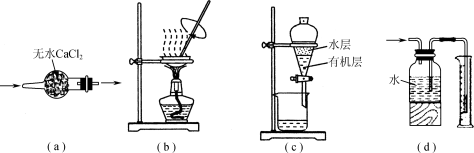
A.用图a所示装置干燥SO2气体
B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体
C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出
D.用图d所示装置测量氯气的体积
难度: 中等查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
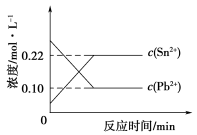
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
难度: 中等查看答案及解析
-
某实验小组依据反应
 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是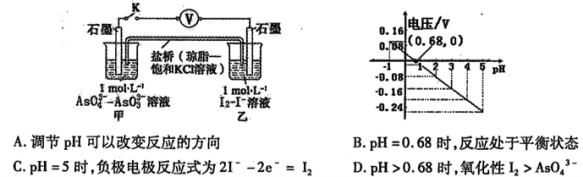
难度: 中等查看答案及解析
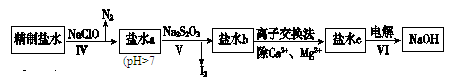
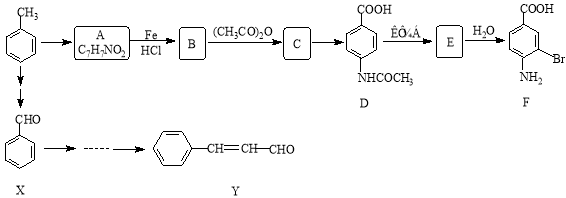
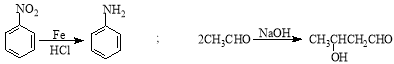 。
。