-
化学与生产生活密切相关。下列做法有利于环境保护和可持续发展的是
A. 大量生产和销售超薄塑料购物袋,方便日常生活
B. 大力推广新能源汽车,建设绿色低碳的交通体系
C. 将废铅蓄电池拆解后的铅泥和废硫酸作深埋处理
D. 加大煤、石油等化石能源的开采,满足发展需求
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 甲苯的结构简式:C7H8
B. 钢铁吸氧腐蚀正极的电极反应式:O2+2H2O+4e-=4OH-
C. 碳酸的电离方程式:H2CO3 = H+ + HCO3-
D. Na2S溶液中S2-水解的离子方程式:S2-+2H2O
H2S +2OH-
难度: 中等查看答案及解析
-
下列反应中△H>0,△S>0的是
A. CaCO3(s)=CaO(s)+CO2(g)
B. NH3(g)+HCl(g)=NH4Cl(s)
C. 4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)
D. 任何温度下均能自发进行2H2O2(l)=2H2O(l)+O2(g)
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. FeCl3溶液具有酸性,可用于脱除燃气中H2S
B. 苯酚能使蛋白质变性,可用于制取酚醛树脂
C. FeS固体呈黑色,可用于除去废水中Cu2+、Hg2+等重金属
D. NaHCO3能与Al2(SO4)3溶液反应,可用作泡沫灭火器原料
难度: 中等查看答案及解析
-
苯与Br2发生取代反应时能量与反应进程如下图所示。下列说法正确的是
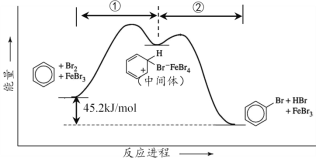
A. ①、②两步均放出能量 B. FeBr3可以改变反应的焓变
C. FeBr3不能改变反应的活化能 D. FeBr3可以加快该反应速率
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2 + H2O
H+ + Cl-+HClO
B. CaCO3加入醋酸中:CO
+ 2H+ = CO2↑ + H2O
C. 用惰性电极电解MgCl2溶液:2Cl-+2H2O
H2↑+ Cl2↑ +2OH-
D. 酸性KMnO4溶液滴入FeSO4溶液中:MnO
+ Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A. 糖类、油脂和蛋白质均是天然高分子
B. C4H9Cl与C4H10O均只有4种同分异构体
C. 盐析可提纯蛋白质并保持其生理活性
D. 石油裂解可得到苯、甲苯、二甲苯及苯酚
难度: 中等查看答案及解析
-
依据下列热化学反应方程式作出的判断正确的是
①CH4(g) +
O2(g)= CO (g)+ 2H2O(g)
H1 = a kJ·mol-1
②CH4 (g)+ 2O2(g)= CO2(g) + 2H2O(g)
H2 = b kJ·mol-1
③C (s)+
O2 (g) = CO (g)
H3= c kJ·mol-1
④H2 (g)+
O2 (g)=H2O (l)
H4 =d kJ·mol-1
A. a>b
B. a + c<b
C. 2CO (g)+O2 (g) =2CO2 (g)的
H =(b-a)kJ·mol-1
D. CO (g) + H2O (g)=CO2 (g)+H2 (g)的
H =(b-a-d)kJ·mol-1
难度: 中等查看答案及解析
-
向四个起始容积相同的密闭容器中充入表中所示气体及相应的量,加入催化剂并控制温度、容积或压强,发生反应2CO(g)+2NO(g)
2CO2(g)+N2(g)
H<0,直至达平衡。下列说法错误的是
编号
条件
起始物质的量/mol
温度/℃
容积或压强
CO(g)
NO (g)
CO2 (g)
N2 (g)
①
600
维持恒容
0.2
0.2
0
0
②
700
维持恒容
0.1
0.1
0.1
0.05
③
600
维持恒容
0.4
0.4
0
0
④
600
维持恒压
0.4
0.4
0
0
A. 平衡时N2的浓度:①>②
B. 平衡时CO的正反应速率:①<②
C. NO的平衡转化率:③>①
D. 平衡时容器内气体总压:④>③>①>②
难度: 中等查看答案及解析
-
2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )
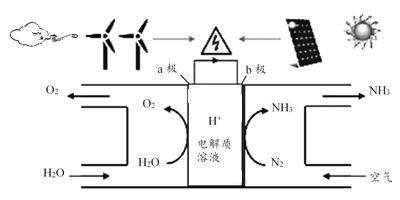
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-=2NH3
D. a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
难度: 困难查看答案及解析
-
来自植物精油中的三种活性成分的结构简式如下。下列说法正确的是
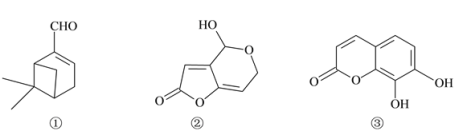
A. ①中含有2个手性碳原子数
B. ②中所有原子可以处于同一平面
C. ②、③均能与FeCl3溶液发生显色反应
D. 1mol③最多可与3molNaOH发生反应
难度: 中等查看答案及解析
-
下列说法正确的是
A. 电解精炼铜时,粗铜与直流电源的负极相连
B. 镀层破损后,镀锡铁片中铁比镀锌铁片中铁耐腐蚀
C. 常温时,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液pH=7
D. 合成氨反应N2(g) + 3H2(g)
2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡
难度: 中等查看答案及解析

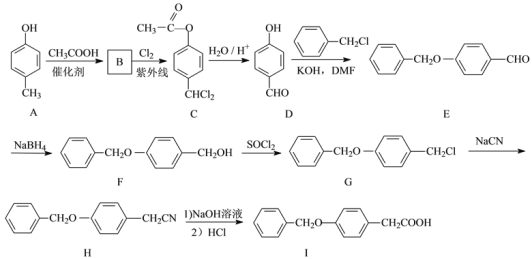
 )______。
)______。
 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______。