-
化学在生产和日常生活中有着重要的作用,下列有关说法正确的是
A. 二氧化硫有漂白性,大量用作棉、麻、纸张和食品的增白
B. 用明矾和FeCl3溶液净水,二者原理相同
C. 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
D. PM2.5含有铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
难度: 简单查看答案及解析
-
下列说法正确的是
A. HOCH2CH=CH2能发生取代反应,加成反应、氧化反应
B. 月桂烯(
)所有碳原子一定在同一平面上
C. 甲烷、乙烯、苯和乙醇都能使酸性KMnO4溶液褪色
D. 油脂皂化反应得到高级脂肪酸与甘油
难度: 中等查看答案及解析
-
下列有关离子方程式书写正确的是
A. Na2CO3溶液除去锅炉中水垢(CaSO4): Ca2++CO32-═CaCO3↓
B. 用惰性电极电解饱和硫酸铜溶液:2Cu2++2H2O
2Cu+O2↑+4H+
C. 铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑
D. 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
难度: 中等查看答案及解析
-
某烷烃相对分子质量为86,若该分子中仅含有3个甲基(—CH3),则其一氯取代物最多有( )种(不考虑立体异构)
A. 7 B. 8 C. 9 D. 10
难度: 中等查看答案及解析
-
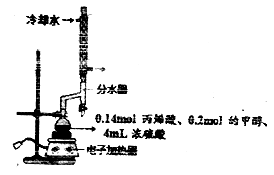
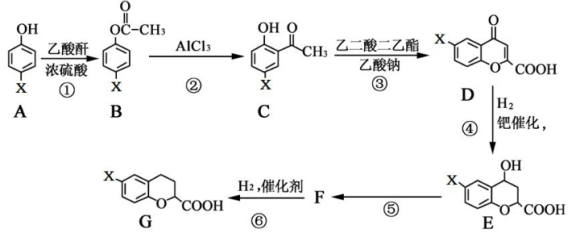
实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是
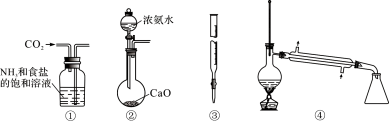
A. 装置①可用于模拟侯氏制碱法制取碳酸氢钠
B. 装置②可用于制备少量NH3
C. 装置③可用于准确量取一定体积K2Cr2O7标准溶液
D. 装置④常用于分离互不相溶的液体混合物
难度: 中等查看答案及解析
-
由原子序数依次递增的短周期元素W、X、Y、Z组成的化合物A在一定条件下完全分解,生成甲、乙、丙、丁四种气体,甲、乙分别能使无水硫酸铜、湿润的红色石蕊试纸变蓝,并能用品红试液检验,丁是大气中与人类生命活动关系最密切的一种气体。下列说法正确的是
A. 原子半径:W<X<Y<Z
B. 1mol简单氢化物分别溶于等体积的水中形成体系的pH:Z>Y>X
C. W与X或Y都能形成既含极性键,又含非极性键的化合物
D. 在化合物A的分解反应中丙为氧化产物,丁为还原产物
难度: 中等查看答案及解析
-
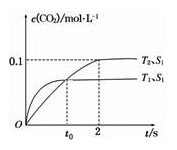
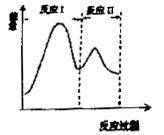
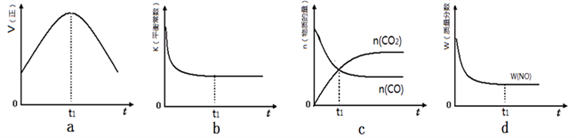
下列示意图与对应的化学反应关系不一致的是
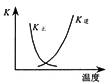
A.2SO2(g)+O2(g) ⇌2SO3(g) △H<0
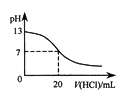
B.25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液
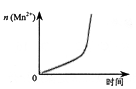
C.酸性KMnO4溶液与过量的H2C2O4溶液混合
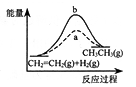
D.CH2=CH2(g)+H2(g)
CH3CH3(g) △H>0,使用催化剂(a)和未使用催化剂(b)
A. A B. B C. C D. D
难度: 中等查看答案及解析
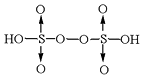 ,H2O2的电子式为______,过二硫酸中氧元素的化合价为________价。
,H2O2的电子式为______,过二硫酸中氧元素的化合价为________价。