-
下列说法正确的是( )
A.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径大于或等于2.5μm的颗粒物,该值越高,代表空气污染程度越严重。
B.最近天津市对小轿车进行“双限”措施,这种做法是防止酸雨的途径之一,也是减少雾霾的途径之一。
C.镀金的钢铁器件既能增加美观,又可以在即使镀层局部破损后防止器件的损耗。
D.工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的。
难度: 中等查看答案及解析
-
下列化学用语书写正确的是( )
A.次氯酸的结构式:H—Cl—O
B.丙烷分子的球棍模型示意图:
C.NH4H的电子式:
D.S2-的结构示意图:
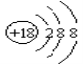
难度: 中等查看答案及解析
-
下列实验操作过程能引起结果偏高的是( )
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗。
②用量筒量取5.0mL溶液时,俯视读数。
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线。
④用已知浓度的盐酸滴定未知浓度的NaOH溶液时,滴定前平视读数,滴定终点仰视读数。
A.③④ B.②③ C.①④ D.①②
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2.L-2
C.Ksp(AB2)小于Ksp(CD),说明AB的溶解度小于CD的溶解度
D.常温下,反应C(s)+CO2(g)==2CO(g)不能自发进行,则该反应的ΔH>0
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10—13 mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
A.78 g Na2O2中含有的阴离子数为2NA
B.1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA
C.8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA
D.NA个Fe(OH)3胶体粒子的质量为107g
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向碳酸氢镁溶液中加人过量氢氧化钠 Mg2++HCO3-+OH-=MgCO3↓+H2O
B.Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+===2Fe3++3H2O
C.大理石溶于醋酸:CaCO3 + 2CH3COOH = Ca(CH3COO)2 + H2O + CO2↑
D.向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全下图装置制取、提纯并收集表中四种Ba2+ + 2OH- + NH4+ +H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
难度: 中等查看答案及解析
-
下列装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )


难度: 中等查看答案及解析
-
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得
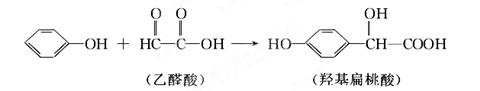
下列有关说法正确的是 ( )
A.苯酚和羟基扁桃酸互为同系物
B.常温下,1 mol羟基扁桃酸只能与2 mol Br2发生加成反应
C.羟基扁桃酸分子中至少有12个原子共平面
D.乙醛酸在核磁共振氢谱中只有1个吸收峰
难度: 中等查看答案及解析
-
有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-离子中的几种。为确定其成分,进行如下实验:①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰。下列推断正确的是 ( )
A.肯定有Na+、Al3+、Mg2+、SO42- B.肯定有Na+、Mg2+、Al3+、HCO3-
C.肯定没有K+、HCO3-、MnO4- D.肯定没有K+、NH4+、Cl-
难度: 中等查看答案及解析
-
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3 。则下列说法错误的是 ( )
A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2
B.NF3是一种无色、无臭的气体,因此NF3在潮湿的空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染
D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023
难度: 中等查看答案及解析
-
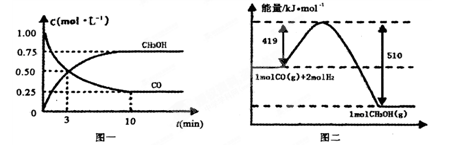
下列关于反应过程中能量变化的说法正确的是( )
A.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
B.图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH>0未使用和使用催化剂时,反应过程中的能量变化
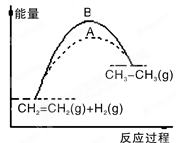
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
难度: 中等查看答案及解析
-
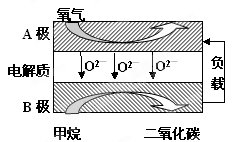
关于右图电化学装置中的电极名称、材料及反应均可能正确的是 ( )

A.阴极(Cu片)2C1――2e-=Cl2↑
B.阳极(Cu片):4OH――4e-=2H2O+O2↑
C.正极(石墨棒):Fe3+ +e-= Fe2+
D.负极(Fe钉):Fe-3e-=Fe3+
难度: 中等查看答案及解析
-
常温下,关于0.1 mol/L NaHY溶液,下列叙述正确的是( )
A.将NaHY晶体加入水中一定能促进水的电离
B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c (Na+)>c (OH-)>c (H+)>c (HY-)
C.若溶液中c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性
D.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c (Na+)>c (HY-)>c (H+)>c (Y2-)>c (H2Y)
难度: 中等查看答案及解析
-
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)
4NO2 (g)+ O2(g) ΔH > 0 T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s
0
500
100 0
150 0
c(N2O5)/mol·L-1
5.00
3.52
2.50
2.50
下列说法中不正确的是 ( )
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )

A.H2SO4浓度为2.5 mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.混合酸中NO3-物质的量为0.4mol
难度: 中等查看答案及解析