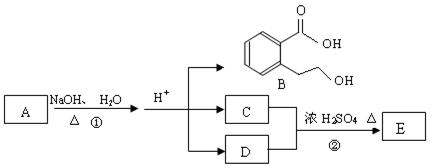
-
用NA表示阿伏伽德罗常数的值。下列叙述正确的是
A.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA
C.室温下,46.0gN2O4和NO2的混合气体中含有的原子数目为3NA
D.78gNa2O2固体中含有的阴离子数为2NA
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+3、+5、-3
-2
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z的氢化物生成ZW
难度: 简单查看答案及解析
-
以下关于有机物的说法中,正确的是
A.生活中食用的食醋、植物油、动物蛋白等物质是纯净物
B.淀粉、纤维素的化学式都可表示为(C6H10O5)n,二者互为同分异构体
C.石油的分馏主要是物理变化,而煤的干馏主要是化学变化
D.乙烯和聚乙烯中均含有不饱和碳碳双键
难度: 简单查看答案及解析
-
下列离子方程式中,错误的是
A.向AlCl3溶液中加入过量氨水:Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+
B.向硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2+ + H2O2 + 2H+ = 2Fe3+ +2H2O
C.碳酸氢钡溶液中加入过量氢氧化钠溶液: Ba2+ +2HCO3-+2OH-=BaCO3↓+H2O + CO32-
D.铜溶解于稀硝酸中:Cu+4H+ +2NO3-=Cu2++ 2NO2 ↑+2H2O
难度: 简单查看答案及解析
-
下列说法不正确的是
A.用丁达尔现象可以区分食盐水和硫酸铜溶液
B.用热的纯碱溶液可以更好地去除油污
C.外加直流电源,将钢铁设备作为阴极进行保护
D.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去
难度: 简单查看答案及解析
-
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 负极 Li-e-==Li+下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
难度: 简单查看答案及解析
-
下列装置、操作及说法正确的是
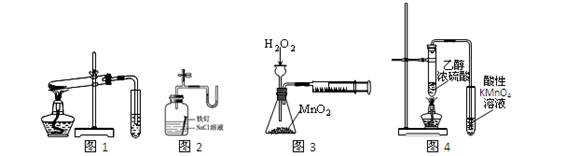
A.图1探究NaHCO3的热稳定性
B.图2证明铁生锈与空气有关
C.图3定量测定H2O2的分解速率
D.图4不能证明CH3CH2OH发生消去反应生成了乙烯
难度: 简单查看答案及解析
-
下列溶液中,微粒的物质的量浓度关系正确的是
A.1.0 mol·L-1的Na2CO3溶液:c(OH-)= c(H+) +c(HCO3-)+2 c(H2CO3)
B.1.0 mol·L-1的NH4Cl溶液:c(NH4+)= c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+) > c(CH3COO-)> c(H+)> c(OH-)
D.向硝酸钠溶液中滴加稀盐酸,得到pH=1的混合溶液:c(Na+) = c(NO3-)
难度: 简单查看答案及解析