-
化学与生活、能源、环科技等密切相关。下列描述错误的是
A. 在厨房里用米汤不能直接检验食盐中是否含有碘
B. 煤炭经过干馏,可获得相对清洁的能源和重要的化工原料
C. 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染
D. 水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 在标准状况下,78g苯的碳碳双键数目为3NA
B. 1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价健数均为4NA
C. 500mL2mol/LNH4NO3溶液中,含有氮原子数目为2NA
D. 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子数效目一定为NA
难度: 中等查看答案及解析
-
25℃时,一定能大量共存的离子组是
A. 0.1mol/L的NH4HSO4溶液:Ba2+、Na+、NO3-、Cl-
B. 通KSCN溶液变红色的溶液:NH4+、Al3+、SO42-、Cl-
C. c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
D. 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3-
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素,原子序数依次增大。W、Z最外层电子数相同,Z的核电荷数是W的2倍,X的焰色反应呈黄色,工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是
A. 原子半径:X>Y>Z>W
B. X、Y和Z三种元素的最高价氧化物的水化物两两之间能相互反应
C. X和Y对应的氯化物都是离子晶体
D. W的最简单氢化物沸点比Z的高
难度: 困难查看答案及解析
-
青霉素在体内经酸性水解后得到一种有机物X。 己知X的结构如下,下列有关X的说法正确的是
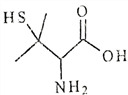
A. X的分子式为C5H10NO2S B. X有2个手性碳原子
C. X能发生加聚反应生成高分子化合物 D. X既能与强酸反应,又能与强碱反应
难度: 困难查看答案及解析
-
欲实现下列实验目的,进行的实验操作合理的是
实验目的
实验操作
A
证明乙二酸具有还原性
向乙二酸溶液中滴加2 滴KMnO4 溶液
B
制备Fe(OH)3胶体
将NaOH溶液滴加到饱和FeCl3溶液中
C
铝可以从铜盐溶液中置换铜
将久置在空气中的铝片放入CuSO4溶液中
D
检验蔗糖是否水解
取蔗糖溶液,加3~5滴稀硫酸,水浴加热5min,取少量溶液,加入银氨溶液加热
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
在某温度时,将nmol/L醋酸溶液滴入10 mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是
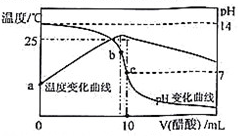
A. n>1.0 B. a点Kw=1.0×10-14
C. 水的电离程度:c>b D. b点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
难度: 困难查看答案及解析
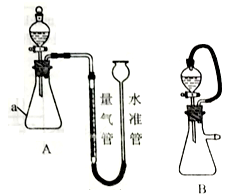
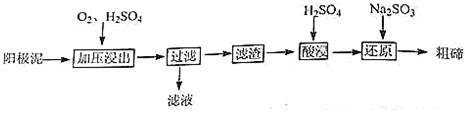



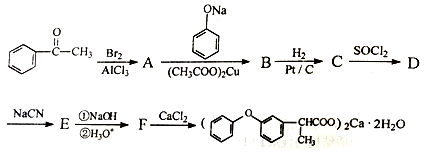
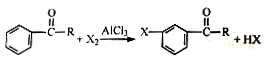 (X表示卤素原子)
(X表示卤素原子)