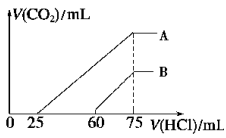
-
在标准状况下,将多余的氨气用水吸收,最好选用装置( )
难度: 简单查看答案及解析
-
某氧化还原反应中有反应物和生成物共六种: NO、FeSO4、Fe(NO3)3、 H2O、 HNO3和 Fe2(SO4)3。其中 HNO3为反应物,则该反应中的还原剂为( )
A. NO B. FeSO4 C.Fe(NO3)3 D.Fe2(SO4)3
难度: 中等查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出 NO 物质的量最多的是( )
A. FeO B. FeSO4 C. Fe2O3 D. Fe3O4
难度: 困难查看答案及解析
-
有 9.7gCu 和 Zn 的合金与足量的稀 HNO3反应, 还原产物只有 NO 气体, 其体积在标准状况下为 22.4L。 将溶液稀释为 1L, 测得溶液的 C(H+)=0.1 mol/L, 此时溶液中 NO3-的浓度为( )
A.0.3mol/L B.0.4mol/L C.0.5mol/L D. 0.6mol/L
难度: 极难查看答案及解析
-
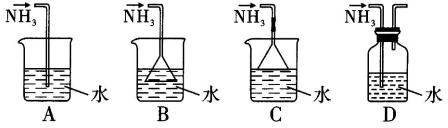
如下图是课外活动小组的同学设计的 4 个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
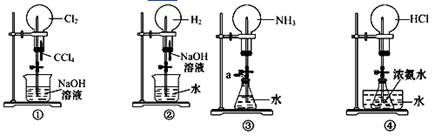
A. 挤压装置①的胶头滴管使 CCl4。全部进入烧瓶,片刻后打开止水夹
B. 挤压装置②的胶头滴管使 NaOH 溶液全部进入烧瓶,片刻后打开止水夹
C. 用鼓气装置从装置③的 a 处不断鼓入空气并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
难度: 困难查看答案及解析
-
把过量铁屑加入氯化铁和氯化铜的混合溶液中,反应结束后,称得固体质量与所加铁屑的质量相等,则原溶液中( )
A. 7:2 B. 3:2 C. 2:3 D. 2:7
难度: 中等查看答案及解析
-
同温同压下, a g 甲气体和 2a g 乙气体所占的体积之比为 1: 2,根据阿伏加德罗定律判断,下列叙述不正确的是( )
A. 同温同压下甲和乙的密度之比为 1: 1
B. 甲与乙的相对分子质量之比为 1: 1
C. 同温同体积下等质量的甲和乙的压强之比为 1: 1
D. 等质量的甲和乙中的原子数之比为 1: 1
难度: 极难查看答案及解析
-
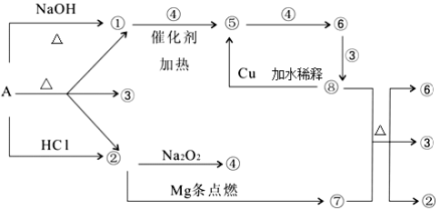
用下图表示的一些物质或概念之间的从属或包含关系中,错误的是( )
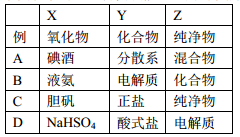
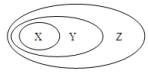
难度: 中等查看答案及解析
-
下列变化必须加入氧化剂才能实现的是( )
A.Na2SO3→SO2 B. HCl→ Cl2 C. Cl2→HClO D. KMnO4→O2
难度: 简单查看答案及解析
-
某无色透明溶液与金属铁反应时只放出氢气,则溶液中可以大量共存的离子是( )
A.Na+、CH3COO-、H+、NH4+ B.H+、NO3-、Ba2+、Mg2+
C.Na+、Cl-、H+、SO42- D.Ba2+、K+、SO32-、S2-
难度: 困难查看答案及解析
-
下列物质在光照时不反应的是( )
A. 氢气和氯气的混合气体 B. 硝酸 C. 氢气和氧气的混合气体 D. 氯水
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A. 澄清石灰水与少量小苏打溶液混合: Ca2++2OH-+2HCO3-= CaCO3↓+CO32-+2 H2O
B. 磁性氧化铁置于氢碘酸溶液中: Fe3O4+8 HI =2Fe3++ Fe2++4 H2O +8I-
C. NaHSO4 溶液中滴加过量 Ba (OH)2溶液: H++SO42-+Ba2++OH-= BaSO4↓+ H2O
D. 用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++ NO↑ H2O
难度: 困难查看答案及解析
-
下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧
②FeSO4 溶液中滴入NaOH 溶液,并在空气中放置一段时间
③FeCl3 溶液中滴入KSCN 溶液
④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④ C.③①②④ D.①②③④
难度: 中等查看答案及解析
-
已知在热的碱性溶液中, NaClO 发生反应: 3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A. NaCl、 NaClO B. NaCl、 NaClO3 C. NaClO、 NaClO3 D. NaClO3、 NaClO4
难度: 中等查看答案及解析
-
NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A.该反应中 NO2被还原 B.反应过程中溶液的pH 减小
C.生成1 mol NaNO3需消耗 0.4mol KMnO4 D.□中的粒子是 OH-
难度: 中等查看答案及解析