-
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( )

A.蒸馏、蒸发、萃取、过滤 B.蒸馏、过滤、萃取、蒸发
C.萃取、过滤、蒸馏、蒸发 D.过滤、蒸发、萃取、蒸馏
难度: 简单查看答案及解析
-
利用下列实验装置完成相应的实验,操作正确且能达到实验目的的是( )
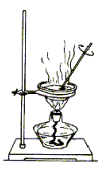
A.实验室中制取少量蒸馏水 B.从NaCl溶液提取NaCl固体
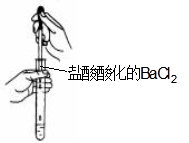

C.检验Na2CO3溶液中是否混有Na2SO4 D.配制200mL 0.10 mol·L-1盐酸
难度: 简单查看答案及解析
-
下列实验能达到实验目的且符合安全要求的是( )
编号 实验 操作
A 钠与水反应 用镊子从煤油中取出金属钠,切下绿豆大小的钠,
小心放入装满水的烧杯中。
B 制备并检验氢气的可燃性 锌粒与稀硫酸反应产生气体,立即点燃。
C 用浓硫酸制稀硫酸 把水沿器壁倒入装有浓硫酸的烧杯中,并用玻璃
棒不断搅拌。
D 一氧化碳还原氧化铜 用石灰水检验气体产物,实验结束时先从水槽中
取出导管,再熄灭酒精灯。
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.1 mol CO2的质量为44g/mol
B.CO2的摩尔质量为44g
C.CO2的摩尔质量等于CO2的相对分子质量
D.NA个CO2的质量与CO2的相对分子质量在数值上相同
难度: 简单查看答案及解析
-
用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LCCl4含有的分子数为 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
难度: 简单查看答案及解析
-
在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高( )
A.所用NaOH已经潮解 B.有少量NaOH溶液残留在烧杯里
C.向容量瓶中加水未到刻度线 D.称量时误用“左码右物”
难度: 简单查看答案及解析
-
下列溶液中,Na+ 浓度最大的是( )
A.1mol/L Na2SO4溶液200mL B.0.9mol/L Na3PO4溶液200mL
C.2.5mol/L NaOH 溶液100mL D.1mol/L NaHCO3溶液300mL
难度: 简单查看答案及解析
-
某盐的混合物中含有0.2 mol Na+、0.4 mol Mg2+、0.4 mol Cl -,则SO42- 为( )
A.0.1 mol B.0.3 mol C.0.5 mol D.0.15 mol
难度: 简单查看答案及解析
-
分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.Na2O和Na2O2都属于碱性氧化物 B.KOH和Na2CO3都属于碱
C.NaHSO4和HNO3都属于酸 D.Na2O和SiO2都属于氧化物
难度: 简单查看答案及解析
-
下面关于电解质的叙述中错误的是( )
A.在水溶液里或熔融状态下能够导电的化合物叫做电解质
B.电解质、非电解质都指化合物而言,单质不属于此范畴
C.电解质在水中不一定能导电,能导电的物质不一定是电解质
D.纯水的导电性很差,所以水不是电解质
难度: 简单查看答案及解析
-
关于胶体和溶液的区别,下列叙述中正确的是( )
A.溶液是透明的,胶体是不透明的
B.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸
C.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明显光带
D.溶液稳定,放置后不会生成沉淀,胶体不稳定,放置会生成沉淀
难度: 简单查看答案及解析
-
下列电离方程式,书写正确的是( )
A.Al2(SO4)3 =2Al3+ + 3SO42- B.AlCl3 = Al3+ +Cl-
C.Mg(NO3)2 = Mg+2 +2NO3- D.KMnO4 =K+ +Mn7+ +4O2-
难度: 简单查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的有( )
A.Na+、H+、CO32-、Cl- B.Mg2+、Al3+、NO3-、OH-
C.K+、 H+、SO42-、OH- D.Al3+、Fe2+、Cl-、SO42-
难度: 简单查看答案及解析
-
下列离子方程式中,书写正确的是( )
A.AlCl3溶液中加入足量的氨水:Al3+ + 3OH- = Al(OH)3↓
B.往碳酸钙中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.Na与硫酸铜溶液反应: 2Na+Cu2+="Cu+" 2Na+
D.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
难度: 简单查看答案及解析
-
下列化学方程式中,能用离子方程式SO42-+Ba2+===BaSO4↓来表示的是( )
A.BaCO3+H2SO4===BaSO4↓+H2O+CO2↑ B.BaCl2+Na2CO3===BaCO3↓+2NaCl
C.BaCl2+Na2SO4===BaSO4↓+2NaCl D.Ba(OH)2+CuSO4===Cu(OH)2↓+BaSO4↓
难度: 简单查看答案及解析
-
若M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为( )
A.+2 B.+3 C.+4 D.+6
难度: 简单查看答案及解析
-
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是
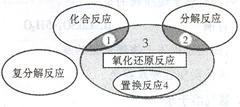
A.4Fe(OH)2+O2+2H2O ===Fe(OH)3
B.2NaHCO3
Na2CO3+H2O+CO2↑
C.4NH3+5O2
4NO+6H2O
D.Zn+H2SO4===ZnSO4 + H2↑
难度: 简单查看答案及解析
-
下列反应中必须加入还原剂才能进行的是( )
A.Cl2→Cl- B.Zn→ Zn2+ C.H2→H2O D.CuO→CuCl2
难度: 简单查看答案及解析
-
已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
A.KClO3是氧化剂
B.被氧化与被还原的氯元素的质量比为5:1
C.H2SO4既不是氧化剂又不是还原剂
D.1mol KClO3参加反应时有10mol电子转移
难度: 简单查看答案及解析
-
铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )
A.都有H2O生成 B.都有H2生成 C.都有AlO2—生成 D.都有Al3+生成
难度: 简单查看答案及解析
-
下列鉴别苏打(Na2CO3)和小苏打(NaHCO3)的方法错误的是( )
A.取两种样品溶液加入澄清石灰水,观察是否出现白色沉淀
B.取固体加热,检验产生气体是否使澄清石灰水变浑浊
C.取固体滴入相同浓度的稀盐酸,观察产生气泡的剧烈程度
D.取相同浓度的两种样品溶液,再滴入相同浓度的稀盐酸,观察产生气泡的剧烈程度
难度: 简单查看答案及解析
-
下列关于焰色反应的说法不正确的是( )
A.只有金属化合物才有焰色反应
B.只有某些金属或其化合物才有焰色反应
C.透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色
D.每次焰色反应实验后都要将铂丝用稀盐酸洗净并灼烧
难度: 简单查看答案及解析
-
把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是( )
A.HCO3- B.Cl- C.Mg2+ D.Na+
难度: 简单查看答案及解析
-
以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
A.先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定有大量的CO32-
C.用洁净的铂丝蘸取该溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色。该溶液中一定含有钾离子,可能含有钠离子
D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
难度: 简单查看答案及解析
-
下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是( )
A.Cu2+ K+ Na+ SO42- B.K+ Na+ Cl-HCO3-
C.Cl-NO3- Mg2+ NH4+ D.NO3- Na+ Cl-K+
难度: 简单查看答案及解析
-
除去下列溶液中的杂质(括号内是杂质)所选试剂正确的是( )
A.NaOH溶液[Ba(OH) 2]:适量Na2SO4溶液
B.HNO3溶液[HCl]:过量AgNO3溶液
C.KOH溶液[K2CO3]:适量CaCl2溶液
D.Mg [Al]:过量NaOH溶液
难度: 简单查看答案及解析
-
下列有关铝化合物说法正确的是( )
A.氧化铝的熔点很高,所以不可以用来冶炼铝
B.氢氧化铝是一种胶状沉淀,有较大表面积,有吸附性,可用作净水剂
C.实验室可以用氢氧化钠与氯化铝来制备氢氧化铝
D.氢氧化铝既可与强酸反应又可与强碱反应,是两性氢氧化物
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1molCl2与足量的铁反应生成FeCl3,转移的电子数是3NA
B.1mol氧气含有的原子数是1mol氖气含有的原子数的两倍
C.7.8g Na2O2中含有阴离子的数目为0.1NA,与足量水反应时电子转移了0.1NA
D.在标准状况下,NA个水分子所占有的体积约为22.4L
难度: 简单查看答案及解析