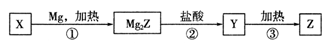
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4。W-的最外层为8 电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B. 原子半径大小:X<Y ,Z>W
C. 化合物Z2Y 和ZWY3都只存在离子键
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
难度: 困难查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是( )
A. 氘(D)原子核外有1个电子 B. 1H与D互称同位素
C. H2O与D2O互称同素异形体 D. 1H218O与D216O的相对分子质量相同
难度: 中等查看答案及解析
-
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于
的叙述错误的是
A. 原子序数116 B. 中子数177 C. 核外电子数116 D. 相对原子质量293
难度: 简单查看答案及解析
-
a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
A. d元素的非金属性最强
B. 它们均存在两种或两种以上的氧化物
C. 只有a与其他元素生成的化合物都是离子化合物
D. b、c、d与氢形成的化合物中化学键均为极性共价键
难度: 中等查看答案及解析
-
W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z B. 单质沸点:X>Y>Z
C. 离子半径:X2->Y+>Z- D. 原子序数:X>Y>Z
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.丙烯的结构简式:C3H6
B.氢氧根离子的电子式:
C.氯原子的结构示意图:
D.中子数为146、质子数为92 的铀(U)原子
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A.乙酸与丙二酸互为同系物
B.不同元素的原子构成的分子只含极性共价键
C.
和
是中子数不同质子数相同的同种核素
D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
难度: 简单查看答案及解析
-
现有aXm+和bYn-两种离子,它们的电子层结构相同,则a的值是
A. b+m+n B. b+m-n C. b-m+n D. b-m-n
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.中子数为10的氧原子:
B.Mg2+的结构示意图:
C.硫化钠的电子式:
D.甲酸甲酯的结构简式:C2H4O2
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。下列说法正确的是
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 困难查看答案及解析
-
X、Y、Z为短周期元素,这些元素原子的最外层电子数分别是1、4、6,则由这三种元素组成的化合物的化学式不可能是()
A. XYZ B. X2YZ C. X2YZ2 D. X2YZ3
难度: 中等查看答案及解析
-
下列各组给定原子序数的元素,不能形成原子数之比为1 : 1 稳定化合物的是( )
A. 3 和17 B. 1 和8 C. 1 和6 D. 7 和12
难度: 简单查看答案及解析
-
硼的最高价含氧酸的化学式不可能是( )
A. HBO2 B. H2BO3 C. H3BO3 D. H2B4O7
难度: 简单查看答案及解析
-
下列说法正确的是()
A.由于水中存在氢键,所以水很稳定
B.能与酸反应生成盐和水的氧化物一定是碱性氧化物
C.Na2O2中既含有离子键,又含有非极性键
D.由于C=O键是极性键,所以CO2 是极性分子
难度: 简单查看答案及解析
-
含有极性键且分子中各原子都满足8 电子稳定结构的化合物是( )
A.CH4 B.CH2=CH2 C.CO2 D.N2
难度: 简单查看答案及解析
-
下列指定微粒的个数比为2 : 1 的是( )
A.Be2+离子中的质子和电子
B.2H原子中的中子和质子
C.NaHCO3 晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
难度: 简单查看答案及解析
-
某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1)。下列有关元素X的说法中正 确的是( )
A. X可能是金属元素
B. 由X形成的含氧酸均为强酸
C. X不能形成化学式为KXO4的含氧酸盐
D. 元素X的气态氢化物一定极易溶于水
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D.
与
得电子能力相同
难度: 中等查看答案及解析
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A. 元素的非金属性次序为c>b>a
B. a和其他3种元素均能形成共价化合物
C. d和其他3种元索均能形成离子化合物
D. 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 中等查看答案及解析
-
北京大学和中国科学院的化学工作者己成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是( )
A.K3C60中既有离子键,又有极性键
B.lmol K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该物质的化学式可写为KC20
难度: 中等查看答案及解析