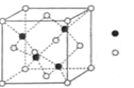
-
下列分子或离子中,含有孤对电子的是( )
A. H2O B. CH4 C. SiH4 D. NH4+
难度: 简单查看答案及解析
-
下列能级中轨道数为5的是( )
A. S能级 B. P能级 C. d能级 D. f能级
难度: 简单查看答案及解析
-
下列基态原子的电子构型中,正确的是( )
A. 3d94s2 B. 3d44s2 C. 3d104s0 D. 3d84s2
难度: 简单查看答案及解析
-
按电子排布,可把周期表里的元素划分成5个区,以下元素属于p区的是( )
A. Fe B. Mg C. P D. La
难度: 简单查看答案及解析
-
下列各原子或离子的电子排布式错误的是( )
A. Al 1s22s22p63s23p1 B. S2- 1s22s22p63s23p4 C. Na+ 1s22s22p6 D. F 1s22s22p5
难度: 中等查看答案及解析
-
下列第三周期元素的离子中,半径最大的是( )
A. Na+ B. Al3+ C. S2- D. Cl-
难度: 简单查看答案及解析
-
元素电负性随原子序数的递增而增强的是( )
A. Na, K, Rb B. N, P, As C. O, S, Cl D. Si, P, Cl
难度: 简单查看答案及解析
-
下列轨道表示式能表示氮原子的最低能量状态的是( )
A.
B.
C.
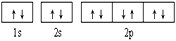 D.
D. 难度: 简单查看答案及解析
-
下列原子中第一电离能最大的( )
A. Na B. Li C. Be D. Mg
难度: 简单查看答案及解析
-
下列分子中,键的极性最强的是( )
A. PH3 B. H2S C. HBr D. HCl
难度: 中等查看答案及解析
-
既有离子键又有共价键和配位键的化合物是( )
A. NH4NO3 B. NaOH C. H2SO4 D. H2O
难度: 中等查看答案及解析
-
膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述不正确的是 ( )
A. PH3分子中有未成键的孤对电子 B. PH3是极性分子
C. 它的分子构型是三角锥形 D. 磷原子采用sp2杂化方式
难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是( )
A. 每一个水分子内含有两个氢键 B. 冰.水和水蒸气中都存在氢键
C. 分子间形成的氢键使物质的熔点和沸点升高 D. H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型相同,熔化时所克服的作用力也完全相同的是( )
A. CO2和SiO2 B. NaCl和HCl C. (NH4)2CO3和CO(NH2)2 D. NaH和KCl
难度: 中等查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A. 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B. NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C. NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D. 氨气分子是极性分子而甲烷是非极性分子
难度: 中等查看答案及解析
-
由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A. 2︰1 B. 1︰1 C. 1︰2 D. 1︰3
难度: 简单查看答案及解析
-
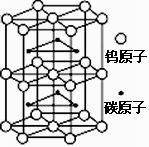
某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
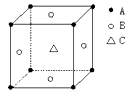
A. 1:3:1 B. 2:3:1 C. 2:2:1 D. 1:3:3
难度: 中等查看答案及解析
-
下列性质中,可以证明某化合物内一定存在离子键的是( )
A. 可溶于水
B. 具有较高的熔点
C. 水溶液能导电
D. 熔融状态能导电
难度: 中等查看答案及解析
-
将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用有:①共价键 ②离子键 ③分子间的作用力正确的顺序是( )
A. ①②②③ B. ②①②③ C. ②③②① D. ①①②③
难度: 中等查看答案及解析
-
下列大小关系正确的是( )
A. 晶格能:NaCl<NaBr B. 硬度:MgO>CaO C. 熔点:NaI>NaBr D. 熔沸点:CO2>NaCl
难度: 中等查看答案及解析
-
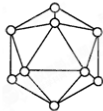
晶体结构属于面心结构的是
A. NaCl B. CsCl C. CO2 D. Cu
难度: 简单查看答案及解析
-
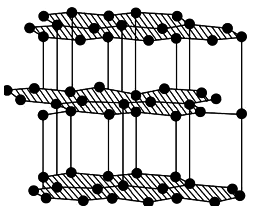
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物。将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等。在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回。下列分析中正确的是( )
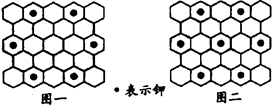
A. 题干中所举出的6种钾石墨,属于同素异形体
B. 若某钾石墨的原于分布如图一所示,则它所表示的是C24K
C. 若某钾石墨的原子分布如图二所示,则它所表示的是C12K
D. 另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4
倍
难度: 中等查看答案及解析