-
对于原电池的电极名称,下列叙述中错误的是
A.电子流入的一极为正极
B.发生还原反应的一极为正极
C.电子流出的一极为负极
D.发生氧化反应的一极为正极
难度: 中等查看答案及解析
-
不能用化学平衡移动原理说明的事实是
A. 合成氨在高压下进行是有利的
B. 温度过高对合成氨不利
C. 使用催化剂能使合成氨速率加快
D. 及时分离从合成塔中出来的混合气,有利于合成氨
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是
A、化学反应速率是指一定时间内任何一种反应物物质的量浓度的减少或任何一种生成物物质的量的增加
B、化学反应速率为0.2 mol /(L·s)是指1s 时某物质的浓度为0.2mol/L
C、决定反应速率的主要因素是反应物的浓度
D、根据化学反应速率的大小可以知道化学反应进行的快慢
难度: 中等查看答案及解析
-
巳知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3C00—、Cl— B.Mg2+、Ba2+、Br—
C.Mg2+、Cl—、I— D.Na+、NH4+、Cl—
难度: 中等查看答案及解析
-
下列物质:①干燥的食盐晶体、②液态氯化氢、③硝酸钾溶液、④稀硫酸、⑤蔗糖溶液、⑥酒精,分别装入容器做导电性实验,灯泡会发光的物质有
A、①②③④⑤ B、 全部不发光 C、全部都发光 D、 ③④
难度: 中等查看答案及解析
-
100.0mL 6.0mol·L-1H2SO4(aq)跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入的物质是
A.Na2CO3(s) B.水 C.Cu D.(NH4)2SO4(s)
难度: 中等查看答案及解析
-
在一定条件下,
达到平衡的标志是
A. NO、O2、NO2分子数目比是2:1:2
B. 反应混合物中各组分物质的浓度相等
C. 混合气体的颜色不再变化
D. 混合气体的平均相对分子质量改变
难度: 中等查看答案及解析
-
对于反应M + N→P,如果温度每升高10℃,反应速率提高为原来的3倍,在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为
A、2min B、3min C、6min D、9min
难度: 中等查看答案及解析
-
反应4NH3(气)+5O2(气)= 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 (x)(反应物的消耗速率或产物的生成速率)可表示为
A.v(NH3)=0.010mol/(L·s) B.v(O2)=0.0010mol/(L·s)
C.v(NO)=0.0010mol/(L·s) D.v(H2O)=0.0045mol/(L·s)
难度: 中等查看答案及解析
-
X、Y、Z、W 4块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W ® Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断4种金属的活动顺序是
A. X>Z>W>Y B. Z>X>Y>W
C. X>Y>Z>W D. Y>W>Z>X
难度: 中等查看答案及解析
-
在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是
A、υ(H2)=0.1 mol·L-1·min-1
B、υ(N2)=0.2 mol·L-1·min-1
C、υ(NH3)=0.15 mol·L-1·min-1
D、υ(H2)=0.3 mol·L-1·min-1
难度: 中等查看答案及解析
-
能正确表示下列化学反应的离子方程式是
A.用氢氧化钠溶液吸收少量二氧化硫:2OH-+SO2=SO32-+H2O
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
氢镍电池是近年开发出来的可充电电池,可以取代会产生隔污染的镉镍电池。氢镍电池的总反应式
H2+NiO(OH)
Ni(OH)2,根据此反应式判断,下列叙述中正确的是
(A)电池放电时,电池负极周围溶液pH不断增大 (B)电池放电时,镍元素被氧化
(C)电池充电时,氢元素被氧化 (D)电池放电时,H2是负极
难度: 中等查看答案及解析
-
水的电离过程为
,在25℃、35℃时其离子积分别为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述中正确的是
A、c(H+)随着温度升高而降低
B、在35℃时,纯水中c(H+)﹥c(OH-)
C、水的电离度a(25℃)﹥a(35℃)
D、水的电离过程是吸热反应
难度: 中等查看答案及解析
-
恒温条件下,把
装入带活塞的密闭容器中,当反应
达到平衡后,慢慢压缩,下列叙述正确的是
A. 体积减半,则压强为原来的两倍
B. 平衡向右移动,混合气体的颜色一定会变浅
C. 体积减半,压强增大,但小于原来的2倍
D. 平衡向右移动,混合气体密度不变
难度: 中等查看答案及解析
-
可逆反应
达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是
A. A为气体,C为固体,正反应为放热反应
B. A为固体,C为气体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应
D. A、C均为气体,正反应为吸热反应
难度: 中等查看答案及解析
-
已知:C(s)+CO2(g)
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
难度: 中等查看答案及解析
-
对于可逆反应2A(气)+B(气)
2C(气) △H﹤0正确的说法是
A.增加A的浓度,平衡向右移动,K值增大
B.增加压强,正反应速度增大,逆反应速度减小,平衡向右移动
C.使用正催化剂,化学平衡向右移动
D.降低温度,正逆反应速度都减慢,化学平衡向右移动
难度: 中等查看答案及解析
-
如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是
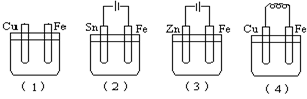
A、(4)(3)(2)(1) B、(4)(3)(1)(2) C、(3)(4)(1)(2) D、 (4) (3)(1)(2)
难度: 中等查看答案及解析
-
6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g) = nZ(g)+2W(g),5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/l·min 则n为
A 4 B 3 C 2 D 1
难度: 中等查看答案及解析
-
对达到平衡状态的可逆反应X+Y
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
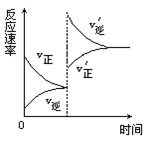
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
难度: 中等查看答案及解析
-
在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应:
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
A.
B.
C.
D.
难度: 中等查看答案及解析