-
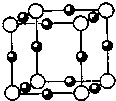
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3; ②还原性:Cl->As; ③每生成1molAs,反应中转移电子的物质的量为3mol; ④M为OH-;⑤SnCl62-是氧化产物.
A.①③⑤
B.①②④⑤
C.①②③④
D.只有①③难度: 中等查看答案及解析
-
美国科学家马丁・查非(Martin Chalfie)、美国华裔化学家钱永健(Roger Tsien)以及日本科学家下村修(Osamu Shimomura)因发现和研究绿色荧光蛋白(green fluorescent protein,GFP)而获2008年度诺贝尔化学奖.GFP在紫外线照射下会发出鲜艳绿光.下列有关说法正确的是( )
A.重金属离子能使GFP变性
B.天然蛋白质属于纯净物
C.GFP发出荧光是蛋白质的颜色反应
D.蛋白质通常用新制氢氧化铜检验难度: 中等查看答案及解析
-
已知:①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1.下列说法中错误的是( )
A.①式表示25℃,101 kpa时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ
B.2H2(g)+O2(g)=2H2O(g)中△H大于-571.6 kJ•mol-1
C.将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量为57.3 kJ
D.将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.100mL1mol•L-1的Na2S溶液中离子总数为0.3NA
B.2.3gNa在空气中完全燃烧失去0.1NA个电子
C.1mol C2H4分子中共用电子对数目为5NA
D.标准状况下,44.8 L CCl4中含2NA个分子难度: 中等查看答案及解析
-
20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性.下图所示为n个C60连接而成的物质X.下列有关说法不正确的是( )
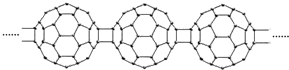
A.X难溶于水
B.一定条件下X可与H2发生加成反应
C.X是碳的一种同素异形体
D.X的摩尔质量为720g难度: 中等查看答案及解析
-
类推是化学学习和研究中常用的思维方法.下列类推正确的是( )
A.Mg可由电解熔融MgCl2制取,Al也可由电解熔融AlCl3制取
B.金属Na着火不能用干冰灭火,金属K着火也不能用干冰灭火
C.SO2能使品红溶液褪色,CO2也能使品红溶液褪色
D.F2、Cl2、Br2、I2的熔点依次升高,N2、P4、As、Sb、Bi的熔点也依次升高难度: 中等查看答案及解析
-
下列三种有机物是某些药物中的有效成分:

以下说法正确的是( )
A.三种有机物都属于芳香烃化合物
B.三种有机物都能与浓溴水发生反应
C.将各1mol的三种物质分别与氢氧化钠溶液充分反应,阿司匹林消耗氢氧化钠最多
D.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种难度: 中等查看答案及解析
-
韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”.下列关于“暖冰”的说法正确的是( )
A.暖冰中水分子是直线型分子
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.暖冰中水分子的各原子均满足8电子稳定结构
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.AgCl的悬浊液中滴入少量Na2S溶液:2AgCl+S2-=Ag2S+2Cl-
B.过量CO2通入Na2SiO3溶液中 SiO32-+CO2+H2O=CO32-+H2SiO3↓
C.Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.纯碱溶液与醋酸反应:CO32-+2H+=H2O+CO2↑难度: 中等查看答案及解析
-
下列说法错误的是( )
A.对于反应C(s)+CO2 (g)=2CO(g)△H>0,升高温度会加快化学反应速率
B.将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者
C.合成氨反应中,当3v(NH3)正=2v(H2)逆时,反应达到平衡
D.对于反应PCl5(g)⇌PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小难度: 中等查看答案及解析
-
(单选题)某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4,其工艺流程如下:

下列推断不合理的是( )
A.往甲中通CO2有利于(NH4)2SO4生成
B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循环使用
D.直接蒸干滤液能得到纯净(NH4)2SO4难度: 中等查看答案及解析
-
在25mL 0.1mol∙L-1 NaOH溶液中逐滴加入0.1mol∙L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是在( )
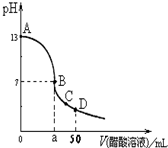
A.A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)难度: 中等查看答案及解析
-
电镀等工业废水中常含有剧毒、致癌的Cr2O72-.该废水处理的一种方法是:利用还原剂把Cr2O72-还原成毒性较低的Cr3+,再加碱生成沉淀.另一种方法是:向废水中加入适当的NaCl,用Fe作电极进行电解.下列说法错误的是( )
A.电解时,阳极反应为:Fe-2e-=Fe2+
B.电解过程中阴极能产生氢气
C.电解法中,转化Cr2O72-的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
D.电解过程中,阳极附近生成Cr(0H)3和Fe(0H)3沉淀难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )

A.混合酸中NO3-物质的量为0.2mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为5mol•L-1难度: 中等查看答案及解析