-
X、Y两元素可形成X2Y3型化合物,下列有关X、Y的叙述正确的是( )
A.X与Y的原子序数差可能为1
B Y的最高正价与最低负价的绝对值的差为4
C 该物质中X原子的半径一定大于Y原子
D.该化合物不可能为共价化合物
难度: 简单查看答案及解析
-
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
难度: 简单查看答案及解析
-
1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。下表给出的是第三周期的七种元素和第四周期的钾元素的电负性的值。下列说法不正确的是( )
元素
Na
Mg
Al
Si
P
S
Cl
K
电负性
0.9
1.2
1.5
?
2.1
2.3
3.0
0.8
A 钙元素的电负性的取值范围在0.8与1.2之间
B. 硫化钠的电子式为
C 硅元素的电负性的取值范围 在1.5与2.1之间
D Al与S形成的化学键可能为共价键
难度: 简单查看答案及解析
-
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )
①B与C均存在同素异形体
②X的种类比Y的多
③沸点:A的氢化物小于C的氢化物
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D.①④
难度: 简单查看答案及解析
-
张青莲是我国著名的化学家。1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值。这是原子量表中首次采用我国测定的相对原子质量值。已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
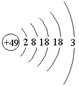
A.In为长周期元素 B.In为过渡元素
C.In容易导电导热 D.In在反应中容易失电子
难度: 简单查看答案及解析
-
已知X、Y是同周期的短周期元素,且电负性X>Y,下列说法正确的是( )
A. X与Y形成化合物中Y显负价,X显正价
B. 若X、Y均为金属元素,则第一电离能Y一定小于X
C. 若X、Y均为非金属元素,则二者对应的最高价氧化物的水化物的酸性X一定弱于Y
D. 气态氢化物的稳定性:HmY小于HnX
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述不正确的是
A.X、Y元素的金属性X<Y
B.X单质在空气中燃烧可以形成化合物X3Z2
C. X和Y均能与氧化物发生置换反应
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
难度: 简单查看答案及解析
-
下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据,下列说法正确的是( )
元素
I1/eV
I2/eV
I3/eV
甲
5.7
47.4
71.8
乙
7.7
15.1
80.3
丙
13.0
23.9
40.0
丁
15.7
27.6
40.7
A 甲的金属性比乙强 B 乙的化合价为+1价
C 丙一定为非金属元素 D 丁一定是金属元素
难度: 简单查看答案及解析
-
下列化合物分子中一定既含单键又含双键的是( )
A.C6H6 B.C2H6O C.COCl2 D.H2O2
难度: 简单查看答案及解析
-
下列有关分子中的化学键描述不正确的是( )
A.苯分子中每个碳原子的sp2杂化轨道形成σ键,未参加杂化的2p轨道形成大π键
B 乙炔分子中每个碳原子都有两个未杂化的2p轨道形成π键
C 乙烯分子中有5个σ键和1个π键
D乙烷分子中C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成的π键
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A 含有配位键的化合物一定是配位化合物
B 配位键实质上是一种共价键
C 配位键也是一种静电作用
D 配位键具有饱和性和方向性
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.H3O+ 是三角锥形结构,O原子为sp3杂化
B. SO2是角形结构,S原子为sp3杂化
C.CHCl3是三角锥形,C原子为sp3杂化
D. AB2可能是V形或直线型,A的杂化方式可能为sp2或sp
难度: 简单查看答案及解析
-
A、B、C三种短周期元素,A、B的电子层数相同,B、C的最外层电子数相同。这三种元素的最外层电子数之和为17,原子核中的质子数之和为31, 下列说法不正确的是( )
A A、B、C中可能有一种是金属元素
B A、B、C一定全是非金属元素
C A、B、C可能有三种组合
D A、B、C中有一种元素的某些性质和硅类似
难度: 简单查看答案及解析
-
“神舟七号”的燃料是氢化锂三兄弟——LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是( )
A.质子数之比为1:2:3 B.中子数之比为1:1:1
C.摩尔质量之比为8:9:10 D.化学性质不相同
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.化合物中一定含有σ键,可能含π键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定都是极性键
难度: 简单查看答案及解析
-
下列各项叙述中,正确的是
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是S区元素
C.所有原子任一能层的S电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是:1s22s22p63s23p63d44s2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.SiH4比CH4稳定
B.O2-半径比F-的小
C. P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
D. Na和Rb属于第ⅠA族元素,Rb失电子能力比Na的强
难度: 简单查看答案及解析
-
下列各元素原子排列中,其电负性减小顺序正确的是( )
A.K>Na>Li B.F>O>S C.P>Mg>Al D.C>N>O
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 基态时相同周期的两种元素的原子所占用的能级和能层是一样的
B.基态时稀有气体元素原子的价层电子数都为8
C.基态时同种元素的原子和离子的轨道排布式一样
D.非金属元素原子的d轨道一定不填充电子或填满电子
难度: 简单查看答案及解析
-
下列各项叙述中,正确的是
A Ge的电负性为1.8,则其是典型的非金属
B L层不含s能级,M层存在3f能级
C 焰火是焰色反应,都是电子由基态跃迁到激发态的结果
D 在电子云示意图中,小黑点是电子在原子核外出现的概率密度的形象描述
难度: 简单查看答案及解析
-
外围电子构型为4f75d16s2元素在周期表中的位置是 (
)
A 六周期ⅢB族 B 五周期ⅢB族 C 六周期ⅦB族 D 四周期ⅦB族
难度: 简单查看答案及解析
-
对基态原子的最外层电子排布式为ns2的元素的表述正确的是( )
A.一定是金属元素 B.一定容易失电子 C.一定是主族元素 D.无法确定
难度: 简单查看答案及解析
-
下列物质中,既存在离子键、共价键,又存在配位键的是:
A. 石墨 B. BaCl2 C. NH4F D. NaOH
难度: 简单查看答案及解析
-
应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是( )
①Be的最高价氧化物的水化物可能具有两性
②H2Se是无色,有毒,比H2S稳定的气体
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥B和Si的最高价氧化物的水化物均为H2XO3形式,且酸性很弱
A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤
难度: 简单查看答案及解析
-
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
,b与c形成的化合物的电子式为
。下列说法中正确的是( )
A.原子半径:a>c>d>b B.电负性:a>b>d>c
C.原子序数:d>a>c>b D.最高价含氧酸的酸性:c>d>a
难度: 简单查看答案及解析
-
下列说法正确的是( )。
A.第4 、5 、6周期的副族元素均为10个
B.第三和第四周期的相同主族元素的原子序数一定相差18
C.相同主族元素的价电子层排布一定相同
D.元素周期表中第四周期第VA族的元素与第三周期IIA元素核电荷数相差13
难度: 简单查看答案及解析
-
X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外排布相同,下列说法中正确的是( )
A.X的原子半径比Y小 B.X和Y的核电荷数之差为m-n
C.电负性X>Y D.第一电离能X<Y
难度: 简单查看答案及解析
-
下列各组微粒,按半径由大到小顺序排列的是( )
A. F-、Na+、Al3+、Cl- B.S2-、K+、O2-、Na+
C.Br-、Br、Cl 、S D. Mg、Ca、K、Na
难度: 简单查看答案及解析
-
下列关于杂化轨道的叙述中,不正确的是
A.分子中中心原子通过SP3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子
C.H2SO4硫酸分子中三种原子均以杂化轨道成键
D.N2分子中N原子没有杂化,分子中有一个σ键、2个π键
难度: 简单查看答案及解析
-
第三周期元素中,基态原子轨道表示式中存在着空轨道的元素有( )种。
A . 1 B. 2 C. 3 D.4
难度: 简单查看答案及解析