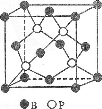
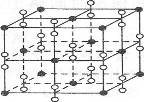
-
如图所示是四种常见有机物的比例模型示意图。下列说法正确的是
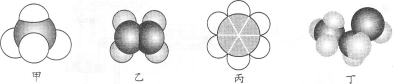
A.22.4 L甲中含有10 mol电子
B.乙与乙的加聚产物都能使溴水褪色
C.丙不能与溴水、酸性高锰酸钾溶液发生反应
D.丙、丁都可以萃取溴水中的溴单质
难度: 中等查看答案及解析
-
化学与生活密切相关.下列说法中不正确的是
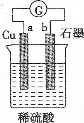
A.“雨后彩虹”是一种与光学和胶体性质相关的自然现象
B.纯银器表面在空气渐渐变暗,是电化学腐蚀所致
C.上图电流表指针偏转,有电流通过
D.在食品中科学使用食品添加剂对人体无害
难度: 中等查看答案及解析
-
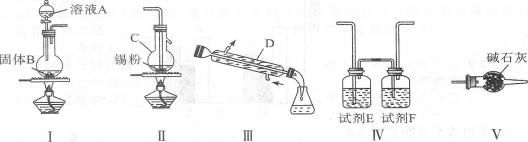
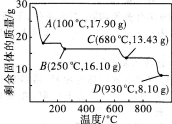
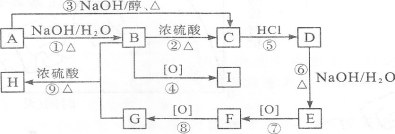
如下图所示装置,通入空气,开启a,b两个活塞,灼热铜丝,下列有关分析正确的是
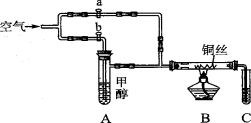
A.灼热铜丝发生的现象变化为紫红色与黑色交替出现,甲醇发生还原反应
B.C中有机产物易溶于水,与水分子间只形成1种氢键
C.检验C中产物的试剂可用1 mol·L-1的CuS04溶液2 mL和0.4 mol·L-1的NaOH溶液4 mL混合得到
D.可用酸性高锰酸钾溶液检验产物生成
难度: 中等查看答案及解析
-
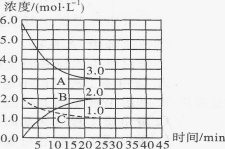
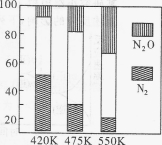
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是
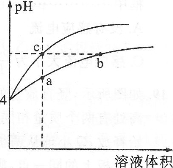
A.a、b、c三点溶液的Kw相同
B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C.用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc
D.a、b、c三点溶液中水的电离程度a>b>c
难度: 困难查看答案及解析
-
相关物质的溶度积常数见下表(25℃):
物质
Mg(OH)2
CH3COOAg
AgCl
Ag2CrO4
Ksp(单位略)
1.1×10-11
2.3×10-3
1.8×10-10
1.9×10-12
下列有关说法中不正确的是
A.浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 mol·L-1的AgN03溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1 的K2CrO4混合溶液中。先产生Ag2CrO4沉淀
C.0.ll mol·L-1的MgCL2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
难度: 困难查看答案及解析
-
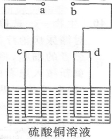
右图是一种正在投入生产的大型蓄电系统的原理图。电池的中间为只允许钠离子通过的离子选择性膜。电池充、放电的总反应方程式为:2Na2S2+NaBr3
Na2S4+3NaBr
下述关于此电池说法正确的是
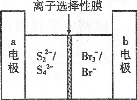
A.充电的过程中当O.1 mol Na+通过离子交换膜时,导线通过0.1 mol电子
B.电池放电时,负极反应为:3NaBr一2e-=NaBr3+2Na
C.充电过程中,电极a与电源的正极相连
D.放电过程中钠离子从右到左通过离子交换膜
难度: 困难查看答案及解析
-
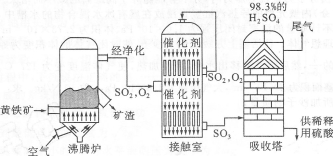
硫酸生产中,其尾气是大气污染来源之一,2SO2(g)+O2(g)
2SO3(g)。现在一种新型纳米材料氧缺位铁酸盐CoFe2OX由铁酸盐CoFe2O4经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。下图是某温度下SO2的平衡转化率(a)与体系总压强(p)的关系,下列说法正确的是
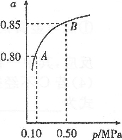
A.新型纳米材料氧缺位铁酸盐CoFe2OX的X的值是5
B.新型纳米材料氧缺位铁酸盐CoFe2OX在将酸性氧化物分解除去的过程中起催化作用
C.温度升高,SO2浓度增大,该反应的焓变为正值
D.平衡状态由A变到B时,平衡常数K(A)=K(B)
难度: 困难查看答案及解析