-
(15分)目前工业合成氨的原理是N2(g)+3H2(g) 2NH3(g) △H=一93.0kJ·mol-1
2NH3(g) △H=一93.0kJ·mol-1
(1)已知一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=十l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为 。
4NH3(g)+3O2(g) △H=十l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为 。
(2)如图,在恒温恒容装置中进行合成氨反应。
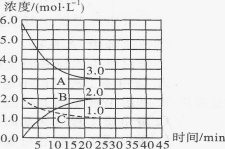
①表示N2浓度变化的曲线是 。
②前25 min内,用H2浓度变化表示的化学反应速率是 。
③在25 min末刚好平衡,则平衡常数K= 。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后.压缩容器,生成更多NH3
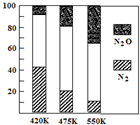
(4)电厂烟气脱氮的主反应①:4NH3(g)+6NO(l) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如图。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如图。
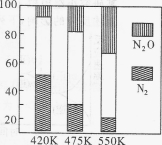
请回答:在400~600 K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3(g)+3O2=2N2+6H2O。则负极电极反应式为 。
(6)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。680℃时所得固体的化学式为 (填字母序号)。
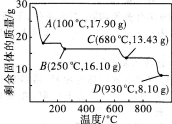
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
-
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)  N2(g)+3H2(g)的平衡常数K= 。
N2(g)+3H2(g)的平衡常数K= 。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 。
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)  2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
-
目前工业合成氨的原理是N2(g)+3H2(g)=2NH3(g) △H=-93.0kJ/mol
(1)已知一定条件下:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=-+1530.0kJ/mol。则氢气燃烧热的热化学方程式为_________________。
(2)如下图,在恒温恒容装置中进行合成氨反应。
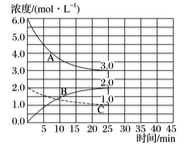
①表示N2浓度变化的曲线是_________。
②前25min内,用H2浓度变化表示的化学反应速率是_____________。
③在25min末刚好平衡,则平衡常数K=___________。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是_______________。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0
副反应为:2NH3(g)+8NO(g)=5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如下图所示。
请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是______,导致这种规律的原因是_________(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3+3O2=2N2+6H2O。则负极电极反应式为_______________。
-
目前工业合成氨的原理是N2(g)+3H2(g)=2NH3(g) △H=-93.0kJ/mol
(1)已知一定条件下:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=-+1530.0kJ/mol。则氢气燃烧热的热化学方程式为_________________。
(2)如下图,在恒温恒容装置中进行合成氨反应。
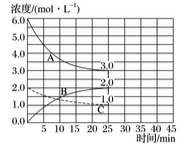
①表示N2浓度变化的曲线是_________。
②前25min内,用H2浓度变化表示的化学反应速率是_____________。
③在25min末刚好平衡,则平衡常数K=___________。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是_______________。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0
副反应为:2NH3(g)+8NO(g)=5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如下图所示。
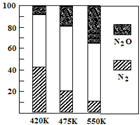
请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是______,导致这种规律的原因是_________(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3+3O2=2N2+6H2O。则负极电极反应式为_______________。
-
目前工业合成氨的原理是N2(g)+3H2(g) 2NH3(g) ΔH=-93.0 kJ·mol-1。
2NH3(g) ΔH=-93.0 kJ·mol-1。
(1)已知一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=+1 530.0 kJ·mol-1。则氢气燃烧热的热化学方程式为___________________。
(2)如下图,在恒温恒容装置中进行合成氨反应。
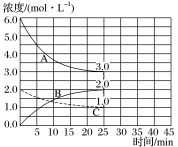
①表示N2浓度变化的曲线是___________。
②前25 min内,用H2浓度变化表示的化学反应速率是__________。
③在25 min末刚好平衡,则平衡常数K=____________。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是________。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应:①4NH3(g)+6NO(g) 5N2(g)+6H2O(g)
5N2(g)+6H2O(g)
ΔH<0,副反应:②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) ΔH>0。平衡混合气中N2与N2O含量与温度的关系如图。
5N2O(g)+3H2O(g) ΔH>0。平衡混合气中N2与N2O含量与温度的关系如图。
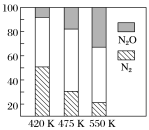
请回答:在400~600 K时,平衡混合气中N2含量随温度的变化规律是_______________,导致这种规律的原因是______________________(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3(g)+3O2===2N2+6H2O。则负极电极反应式为_________________。
-
科学家一直致力于“人工固氮”的新方法研究。目前合成氨技术原理为:N2(g) + 3H2(g) 2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.点d和点e处的n(N2)不相同
D.点e反应达到化学平衡状态,反应停止
-
已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)  2NH3(g);△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为α1,放出热量为Q1。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时测得NH3的转化率为α2 ,吸收热量为Q2。下列说法错误的是 ( )
2NH3(g);△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为α1,放出热量为Q1。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时测得NH3的转化率为α2 ,吸收热量为Q2。下列说法错误的是 ( )
A.Q1 + Q2 = 92.0KJ B.α1 + α2 = 1
C.Q1 + Q2 = 184.0KJ D.α1/α2 = Q1/ Q2
-
已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)  2NH3(g) △H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是( )
2NH3(g) △H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是( )
A.吸收18.4KJ热量 B.放出73.6KJ热量
C.放出18.4KJ热量 D.吸收73.6KJ热量
-
已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)  2NH3(g) △H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是
2NH3(g) △H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是
A.吸收18.4KJ热量 B.放出73.6KJ热量
C.放出18.4KJ热量 D.吸收73.6KJ热量
-
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H= +1530.0kJ /mol。
4NH3(g)+3O2(g) △H= +1530.0kJ /mol。
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是________。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩装置,生成更多NH3
(3)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。
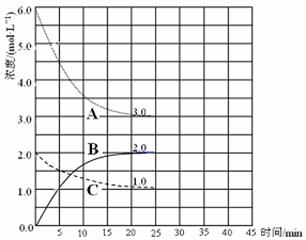
① 表示N2浓度变化的曲线是________。
② 前25 min 内,用H2浓度变化表示的化学反应速率是________。
③ 在25 min末刚好平衡,则平衡常数K = ________。
(4)在第25 min 末,保持其它条件不变,升高温度,在第35 min末再次平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)已知常温下,NH4+ 的水解常数为1.0×10-9,则0.1mol/L NH4Cl溶液pH=________。(忽略NH4+水解对NH4+浓度的影响)
2NH3(g) △H=一93.0kJ·mol-1
4NH3(g)+3O2(g) △H=十l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为 。

5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如图。








