-
下列说法正确的是
A.活化分子碰撞即发生有效碰撞
B.升高温度会加快反应速率,原因是增加了活化分子的碰撞次数
C.某一反应的活化分子百分数是个定值
D.活化分子的碰撞不一定是有效碰撞
难度: 简单查看答案及解析
-
一定温度下,向aL体积固定的密闭容器中加入2molN2(g)、1moH2(g),发生如下反应:N2(g)+3H2(g)
3NH3(g),此反应达到平衡状态的标志是
A.相同时间内消耗n mol N2的同时消耗3n mol H2
B.H2的体积分数不再发生变化
C.容器内原子总数不再发生变化
D.容器内气体的密度不再发生变化
难度: 中等查看答案及解析
-
一个恒容容器中盛有1molNO2,发生反应:2NO2(g)
N2O4(g),反应达到平衡时,混合气体中NO2所占体积分数为M%。保持温度不变,再投入1molNO2,达到平衡时,混合气体中NO2所占体积分数为N%。则M和N的关系是
A.M>N B.M<N C.M=N D.不能确定
难度: 中等查看答案及解析
-
有一化学平衡:mA(g)+nB(g)
pC(g)+qD(g)。如图表示的是A的转化率与压强P、温度T的关系。分析图中曲线可以得出的结论是
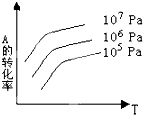
A.正反应吸热,m+n>p+q B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q D.正反应放热,m+n<p+q
难度: 困难查看答案及解析
-
已知某条件下,合成氨反应的数据如下:N2(g)+3H2(g)
2ΝΗ3(g)
起始浓度/mol•L-1
1.0
3.0
0.2
2s末浓度/mol•L-1
0.6
1.8
1.0
4s末浓度/mol•L-1
0.4
1.2
1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是
A.2s末氨气的反应速率=0.4mol•(L•s)-1
B.前2s时间内氨气的平均反应速率=0.4mol•(L•s)-1
C.前4s时间内氨气的平均反应速率=0.3mol•(L•s)-1
D.2~4s时间内氨气的平均反应速率=0.2mol•(L•s)-1
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是:

A.反应开始到10s,用Z表示的反应速率为0.158mol/(L•s)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)
Z(g)
难度: 中等查看答案及解析
-
反应3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.把Fe粉变成Fe片
B.将容器的体积缩小一半
C.保持容积不变,充入N2使容器压强增大
D.压强不变,充入N2使容器体积增大
难度: 中等查看答案及解析
-
对于反应aX(g)+bY(g)
cZ(g)+dR(g) △H=QkJ/mol反应开始时,容器内充入X、Y或Z、R如图所示表示反应达到平衡后,图1、图2分别表示反应达到平衡后,改变温度和压强对反应的影响,下列叙述中正确的是
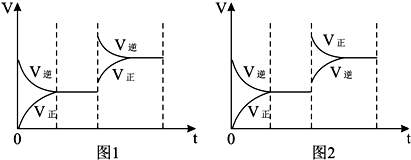
A.开始时充入X和Y a+b>c+d Q<0
B.开始时充入X和Y a+b>c+d Q>0
C.开始时充入Z和R a+b>c+d Q<0
D.开始时充入Z和R a+b<c+d Q>0
难度: 中等查看答案及解析
-
如图
为直流电源,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为电镀槽.接通电路后发现
上的c点显红色.为实现铁上镀锌,接通
后,使c、d两点短路.下列叙述正确的是

A.a为直流电源的负极 B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板 D.e极发生还原反应
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl—2e-=Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿的空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X.这四种金属的活动性顺序是
A.Y>Z>W>X B.Z>Y>W>X C.W>Z>Y>X D.X>Y>Z>W
难度: 中等查看答案及解析
-
将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体体积(标准状况)为
A.3.36L B.4.48L C.5.6L D.6.72L
难度: 困难查看答案及解析
-
下列关于铜电极的叙述正确的是
A.铜铁作电极的原电池中铜是正极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
难度: 中等查看答案及解析
-
可用于电动车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
难度: 困难查看答案及解析
-
控制适合的条件,将反应2Fe3++2I-
2Fe2++I2设计成原电池。下列判断不正确的是

A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
难度: 中等查看答案及解析
-
已知蓄电池在充电时作电解池,放电时作原电池,铅蓄电池上的两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”,关于标有“+”的接线柱,下列说法中正确的是
A.充电时作阳极,放电时作负极
B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时放正极
难度: 中等查看答案及解析
-
实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需要浓度,如此操作的目的是
A.防止硫酸铁分解 B.抑制硫酸铁水解
C.提高硫酸铁的溶解度 D.提高溶液的PH
难度: 简单查看答案及解析
-
能说明溶液呈中性的最可靠依据是
A.pH=7 B.c(H+)=c(OH-)
C.pH试纸不变色 D.石蕊试液不变色
难度: 简单查看答案及解析
-
有等体积、等pH的H2SO4、HCl和CH3COOH三种酸溶液,滴加等浓度的氢氧化钠溶液将它们恰好中和,用去碱的体积分别为V1、V2、V3,则这三者的关系是
A.V1=V2>V3 B.V1=V2=V3 C.V3>V2>V1 D.V3>V2=V1
难度: 中等查看答案及解析
-
下列说法正确的是
A.酸式盐的水溶液一定显碱性
B.只要酸和碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等
D.碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的2倍
难度: 中等查看答案及解析
-
将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合后,溶液中下列微粒的物质的量浓度的关系正确的是
A.c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)
B.c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)
C.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
D.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
难度: 中等查看答案及解析
-
为了得到比较纯净的物质,使用的方法恰当的是
A.向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
难度: 中等查看答案及解析
-
有A、B、C、D四种一元酸的溶液。实验表明:(1)物质的量浓度相同的A、C溶液中,分别滴入甲基橙试液后,A溶液呈黄色而C中不变色(2)物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液的pH小于C的钠盐溶液的pH;(3)A酸和D的钠盐反应生成A的钠盐和D酸。由此可以确定四种酸的酸性由强到弱的顺序中正确的是
A.B>C>A>D B.A>C>D>B C.D>A>C>B D.C>D>A>B
难度: 中等查看答案及解析
-
现有0.01mol/L的下列溶液:①CH3COOH ②NaHCO3 ③NaHSO4 ④KOH ⑤H2SO4 按pH由小到大的顺序排列的是
A.⑤③①②④ B.③⑤①②④ C.⑤②③①④ D.④②①③⑤
难度: 中等查看答案及解析
-
水是一种极弱的电解质,在常温下平衡每n个水分子只有一个水分子发生电离,n的值是
A.1×1014 B.55.6×107 C.1×107 D.55.6
难度: 中等查看答案及解析


