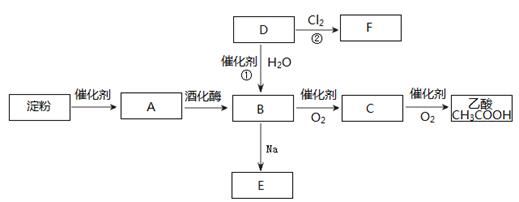
-
锗(Ge)是第四周期第ⅣA族元素,处于元素周期表中金属区与非金属区的交界线上,下列叙述正确的是
A. 锗是一种金属性很强的元素 B. 锗的单质具有半导体的性能
C. 锗化氢(GeH4)稳定性很强 D. 锗酸(H4GeO4)是难溶于水的强酸
难度: 中等查看答案及解析
-
下列药品在实验室中能存放在同一橱柜中的是( )
①NaOH ②浓硫酸 ③浓盐酸 ④KOH ⑤金属钠 ⑥酒精 ⑦苯
A. ⑤和⑥、④和⑤ B. ②和③、①和②
C. ②和③、⑥和⑦ D. ④和⑤、④和⑥
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 制普通玻璃的主要原料是烧碱、石灰石、石英
B. SiO2是光
导纤维的主要成分,晶体硅可用于制作半导体材料
C. 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液
D. 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔
B. 海水中含有丰富的碘元素,因此碘被称为“海洋元素”
C. 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色
D. 用蒸馏的方法可将CCl4和Br2的混合物分开
难度: 简单查看答案及解析
-
下列试剂的保存或使用正确的是
A. 实验室的氯水需要保存在棕色试剂瓶中
B. 漂白粉比氯水稳定,可露置在空气中
C. 称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码
D. 金属钠可保存在煤油、四氯化碳等有机溶剂中
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列说法不正确的是( )
A. H2SO4的摩尔质量(g/mol)与NA个硫酸分子的质量(g)在数值上相等
B. NA个氧气分子和NA个氮气分子的质量比为8∶7
C. 28 g氮气所含原子数目为NA
D. 在标准状况下,0.5 NA个氯气分子所占的体积为11.2 L
难度: 中等查看答案及解析
-
在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )
A. CO2 B. PCl3 C. CCl4 D. H2O
难度: 简单查看答案及解析
-
核电荷数为1~18的元素中,最外层电子数是电子层数3倍的原子
A. 只有4种 B. 只有3种 C. 只有2种 D. 只有1种
难度: 中等查看答案及解析
-
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是
A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
难度: 中等查看答案及解析
-
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③非金属性:F>C>O
④氧化性:Li+﹤Na+﹤K+
⑤气态氢化物沸点:HF>HCl
A. ①②③ B. ①②⑤ C. ②③④ D. ①②④⑤
难度: 困难查看答案及解析
-
下列各组化合物中,不论以什么比例混合,只要总物质的量一定,则完全燃烧生成H2O的量和消耗O2的量不变的是( )
A. CH4O C3H4O5 B. C3H6 C4H6O3
C. C2H2 C6H6 D. C3H8 C4H6
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
A. Al在氧气中燃烧生成A12O3,将Al片改成Al粉
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. 在K2SO4与BaCl2两溶液反应时,增大压强
D. Na与水反应时增大水的用量
难度: 中等查看答案及解析
-
在一个体积固定的密闭容器中,进行可逆反应A(s)+3B(g)
3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
①C的生成速率与C的分解速率相等;②单位时间内生成amol A,同时生成3amol B;
③B的浓度不再变化; ④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1:3:3; ⑥混合气体的密度不再变化;
A. ①③⑥ B. ①③④⑥ C. ①②③ D. ①③④⑤
难度: 困难查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
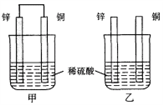
A. 两烧杯中溶液的pH均增大
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中铜片表面均无气泡产生
D. 产生气泡的速度甲比乙慢
难度: 简单查看答案及解析
-
下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是 ( )
A. 盐酸和NaOH溶液混合 B. 氯化氢溶于水
C. 溴化氢气体与氨气相遇反应 D. 锌和稀硫酸反应
难度: 中等查看答案及解析
-
下列变化需克服相同类型作用力的是 ( )
A. 碘和干冰的升华 B. 硅和C60的熔化
C. 氯化氢和氯化钠的溶解 D. 溴和汞的气化
难度: 中等查看答案及解析
-
配制物质的量浓度为0.1mol•L-1的Na2CO3溶液100 mL时,下列操作正确的是
A. 用托盘天平称取1.06 g 无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 定容时,若仰视,则所配溶液的浓度将偏高
难度: 中等查看答案及解析
-
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A. 先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的SO42-
B. 加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的CO32-
C. 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体,该气体可以使湿润的红色石蕊试纸变蓝,则溶液中一定含有大量的NH4+
D. 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
难度: 中等查看答案及解析
-
由乙烷和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为( )
A. 15% B. 21% C. 25% D. 无法确定
难度: 中等查看答案及解析
-
下列有关纯碱和小苏打的叙述中正确的是 ( )
A. Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应
B. 等质量Na2CO3、NaHCO3分别与相同浓度的盐酸反应,NaHCO3消耗的盐酸体积少
C. 向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀
D. 等物质的量Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多
难度: 中等查看答案及解析
-
下列离子组能以较大浓度共存的是( )
A. 含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
B. 使酚酞试液变红的溶液:Na+、Cl-、SO42-、CO32-
C. 含有0.1mol·L-1Ca2+的溶液中:Na+、K+、CO32-、Cl-
D. 碳酸氢钠溶液:K+、SO42-、Cl-、H+
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是 ( )
A. 碳酸钙和盐酸反应:CO32- +2H+= CO2↑ +H2O
B. 向NaOH溶液中滴加少量Ca(HCO3)2溶液:Ca2+ +HCO3- +OH- = CaCO3↓+H2O
C. 铜粉与氯化铁溶液反应:Cu + Fe3+ = Fe2+ + Cu2+
D. 向Ba(OH)2溶液与H2SO4反应:Ba2+ + 2OH- + 2H+ +SO42- = BaSO4↓ + 2H2O
难度: 困难查看答案及解析
-
将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是
A. 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B. 往溶液中滴入无色KSCN溶液,显红色
C. Fe2+和Fe3+物质的量之比为5∶1
D. 氧化产物和还原产物的物质的量之比为2∶5
难度: 中等查看答案及解析
-
宋代著名法医学家宋慈 的《洗冤集录》中有―银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2===2X+2H2O,下列说法不正确的是
A. X的化学式为Ag2S B. 银针验毒时,空气中氧气得到电子
C. 反应中Ag和H2S均是还原剂 D. 每生成1mo1X,反应转移2mo1 e-
难度: 中等查看答案及解析
-
已知:SO32-+I2+H2O=SO42-+2I-+2H+,某无色溶液中可能含Na+、NH+ 4、Cu2+、K+、I-、SO32-,SO42-,且所有离子物质的量浓度相等。向溶液中滴加少量氯水,溶液呈无色(不考虑盐类的水解及水的电离)。下列关于该溶液的判断正确的是
A. 肯定不含I- B. 不能确定是否含有SO42-
C. 至少含有Na+、NH+ 4、K+中的两种 D. 可能含有Cu2+
难度: 困难查看答案及解析