-
今年4月26 日,中国第一艘国产001A 型航母顺利建成下水,有盐分的海水和空气会对船体造成腐蚀,因此船体的防腐处理非常重要。下列关于金属腐蚀和防腐的说法错误的是
A. 可以在船舶外壳装上锌块,用牺牲阳极的阴极保护法防止金属腐蚀
B. 海上舰艇的腐蚀主要为金属的化学腐蚀
C. 刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀
D. 外加电流,将需要保护的金属做阴极,可以起到保护金属的作用
难度: 简单查看答案及解析
-
下列能量转化过程中化学能转化为热能的是
A. 盐类的水解 B. 冰雪融化 C. 酸碱的中和 D. 煅烧石灰石制生石灰
难度: 简单查看答案及解析
-
下列溶液一定呈酸性的是
A.pH=6的溶液 B.含有H+的溶液
C.遇酚酞显无色的溶液 D.c(H+)>c(OH-)的溶液
难度: 简单查看答案及解析
-
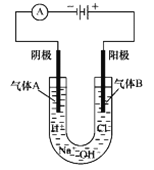
某原电池总反应为:Cu+2Fe3+==Cu2++2Fe2+,下列能实现该反应的原电池是
A
B
C
D
电极材料
Cu、C
Cu、Ag
Cu、Zn
Fe、Zn
电解质溶液
Fe(NO3)3
FeSO4
FeCl3
CuSO4
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
常温下,下列事实能说明HClO是弱电解质的是
A. 0.01mol/L的HClO溶液pH>2
B. NaClO、HClO 都易溶于水
C. HClO 不稳定,见光或受热易分解
D. HClO 与Na2SO3溶液反应,可以得到Na2SO4
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. pH= 13 的溶液中:Na+、AlO2-、A13+、ClO-
B. c(H+ )/c(OH-)=1×10-6的溶液中:K+、Fe3+、Cl-、SO42-
C. 水电离出来的c(H+)=1×10-12mol/L 的溶液中:NH4+、K+、NO3-、Fe2+
D. c(H+ )<c(OH-)的溶液中:Na+、K+、SO42-、ClO-
难度: 简单查看答案及解析
-
一定条件下,乙烷发生分解反应: C2H6
C2H4+ H2。一段时间后,各物质的浓度保持不变,这说明
A.反应完全停止
B.反应达到平衡状态
C.反应物消耗完全
D.正反应速率大于逆反应速率
难度: 简单查看答案及解析
-
下列表示物质变化的化学用语正确的是
A. NH3·H2O的电离方程式:NH3·H2O==NH4++OH-
B. 铁发生吸氧腐蚀的正极反应方程式:O2+2H2O+ 4e-==4OH-
C. 碳酸钠水解的离子方程式:CO32-+2H2O
2OH-+ H2CO3
D. CO燃烧热的热化学方程式:2CO(g) +O2(g)=2CO2(g) △H =-566.0kJ·mol-1
难度: 中等查看答案及解析
-
下列问题,与盐类水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
②NaHCO3与Al2(SO4)3两种溶液用于制造泡沫灭火器
③将含有CaSO4的水垢用Na2 CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②⑤ B. ②③④ C. ①②④⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
反应A(g) +3B(g)
2C(g) +2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A. v(A)=0.15mol/(L·min) B. v(B)=0.04mol/(L·s)
C. v(C)=0.03 mol/(L·s) D. v(D)=0.4 mol/(L·min)
难度: 中等查看答案及解析
-
体积恒定的密闭容器中,反应2SO2(g)+O2(g)
2SO3(g) △H <0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
难度: 中等查看答案及解析
-
下列措施或事实不能用勒夏特列原理解释的是
A. H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2 +I2(g)
2HI)
B. 合成氨时,将混合气体中的NH3液化有利于提高产率
C. 实验室用排饱和食盐水的方法收集氯气
D. 滴加酚酞的氨水中加入氯化铵固体后红色变浅
难度: 中等查看答案及解析
-
一定条件下,下列反应不可能自发进行的是
A. 2O3(g)==3O2(g) △H<0
B. CaCO3(s)==CaO( s)+ CO2(g) △H>0
C. N2(g) +3H2(g)
2NH3(g) △H<0
D. 2CO(g)=2C(s)+ O2(g) △H>0
难度: 简单查看答案及解析
-
25℃时将pH= 3的强酸与pH= 12的强碱溶液混合( 忽略混合时溶液体积变化),所得溶液pH=10,则强酸与强碱的体积比是
A. 1:9 B. 9:1 C. 1:11 D. 11:1
难度: 中等查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
将Na2CO3溶液由0.1mol/L
稀释到0.01mol/L,测溶渡pH
溶液pH变小
稀释后CO32-的水解程度减小
B
向一定浓度的CuSO4溶液中
通入适量的H2S气体
出现黑色沉淀
H2S的酸性比H2SO4强
C
将盛有棕红色NO2气体的注射
器由10 mL 压缩至5 mL
气体颜色比压
缩前变浅
反应2NO2
N2O4向右移动
D
在新生成的AgCl 沉淀中滴入
稀KI溶液,振荡
白色沉淀转化为
黄色沉淀
Ksp (AgCl )>Ksp (AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知:C(s)+O2(g)=CO2 (g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O2(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0 B. △H2>0,△H3>0
C. △H1=△H2+△H3 D. △H3=△H4+△H5
难度: 简单查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
难度: 中等查看答案及解析
-
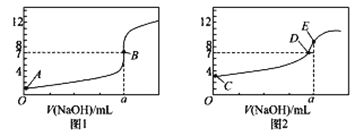
常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示(不考虑NH3的逸出)。下列说法不正确的是( )

A. 反应过程中:c(NH4+)+c(H+)=c(OH-)+c(Cl-)
B. V(HCl)=10.00mL时,c(NH4+)>c(Cl-)>c(NH3•H2O)
C. V(HCl)<20.00mL时,溶液一定呈碱性
D. V(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3•H2O)
难度: 中等查看答案及解析
-
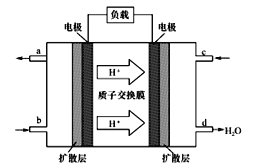
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
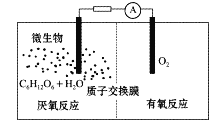
A. 该电池不适宜在过高或过低温度下使用
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+ 6O2==6CO2 +6H2O
难度: 中等查看答案及解析
-
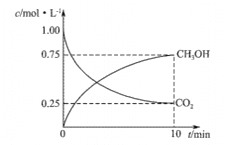
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
难度: 中等查看答案及解析