-
下列有关物质分类的说法中,正确的是( )
A. 烧碱、冰醋酸、石墨均
为电解质
B. 液态HC1不导电,所以HC1不是电解质
C. BaS04虽然难溶于水,但属于强电解质
D. NH3溶于水形成的溶液能导电,所以NH3是电解质
难度: 简单查看答案及解析
-
在0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正反应方向移动
难度: 中等查看答案及解析
-
下表是常温下某些一元弱酸的电离常数:
弱酸
HCN
HF
C
H3COOH
HNO2
电离常数
4.9×10-10
7.2×10-4
1.8×10-5
6.4×10-6
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A.HCN B.HF C.CH3COOH D.HNO2
难度: 简单查看答案及解析
-
25 ℃时,0.1 mol/L稀醋酸加水稀释,右图中的纵坐标y可以是( )
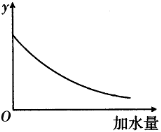
A.溶液的pH B.醋酸的电离平衡常数
C.溶液中醋酸的物质的量浓度 D.醋酸的电离程度
难度: 中等查看答案及解析
-
下列溶液显酸性的是( )
①pH<7的溶液
②c(H+)=c(OH-)的溶液
③c(H+)=1×10-6 mol·L-1的溶液
④c(H+)>c(OH-)的溶液 ⑤0.1 mol·L-1的NH4Cl溶液 ⑥NaHCO3溶液
A.①③④⑤⑥ B.②④⑤⑥ C.⑤⑥ D.④⑤
难度: 简单查看答案及解析
-
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是 ( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH一)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH
3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
D.洗涤油污常用热的碳酸钠溶液
难度: 中等查看答案及解析
-
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=2的两溶液稀释后pH仍相同,盐酸稀释的程度大于醋酸稀释的程度
D.两溶液中分别加入少量对应的钠盐固体,c(H+)均明显减小
难度: 中等查看答案及解析
-
在硫化钠溶液中存在的下列关系不正确的是( )
A.c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
B.c(Na+)+c(H+)=c(OH-)+c(HS
-)+c(S2-)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.c(Na+)>c(S2-)>c(OH-)>c(HS-)
难度: 中等查看答案及解析
-
下列关于0.10 mol·L-1NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3=Na++H++CO
B.25 ℃时,加水稀释后,c(H+)与c(OH-)的乘积不变
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO
)+c(CO
)
D.温度升高,c(HCO
)增大
难度: 中等查看答案及解析
-
下列实验操作和数据记录都正确的是( )
A. 用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2 g
B. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
C. 用干燥的广泛pH试纸测稀盐酸的pH=3.2
D. 用10 mL量筒量取NaCl溶液,体积为9.2 mL
难度: 中等查看答案及解析
-
温度相同,浓度均为0.1 mol·L-1的:
①(NH4)2CO3,②(NH4)2Fe(SO4)2,③氨水,④NH4NO3,⑤ NH4HSO4溶液,它们中的c(NH
)由大到小的排列顺序是( )
A.②⑤④①③ B.③⑤②④①
C.②①⑤④③ D.⑤②
①④③
难度: 中等查看答案及解析
-
下列关系的表述中,正确的是( )
A.0.1mol· L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C.pH=3的盐酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等
D.0.1mol· L-1NaHCO3溶液中:c(Na+)>c(HCO3)>c(H2CO3)>c(CO32-)
难度: 中等查看答案及解析
-
为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,该试剂是( )
A.NaOH B.MgO C.氨水 D.Na2CO3
难度: 简单查看答案及解析
-
常温时,将足量的AgCl分别加入下列各溶液中,AgCl的溶解度最小的是 ( )
A.15mL 1.5 mol·L-1的AgNO3溶液 B.10mL 2 mol·L-1的NaCl溶液
C.5mL 1 mol·L-1的AlCl3溶液 D.5mL 1.4 mol·L-1的BaCl2溶液
难度: 中等查看答案及解析
-
有关AgCl沉淀的溶解平衡的说法正确的是( )
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
B.除去溶液中的Mg2+,用O
H-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
C.升高温度,AgCl的溶解度增大,Ksp不变
D.向AgCl饱和溶液中加入NaCl固体,AgCl的溶解度和Ksp都不变
难度: 中等查看答案及解析
-
某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH 随溶液体积变化的曲线如图所示。据图判断下列说法错误的是( )
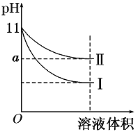
A.a的数值一定大于9
B.Ⅱ为氨水稀释时溶液的pH变化曲线
C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D.完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)
难度: 困难查看答案及解析
-
下列关于电解质溶液的叙述中正确的是( )
A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
B.常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH
)前者小于后者
D.常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1,则此溶液可能是盐酸
难度: 中等查看答案及解析