-
已知水的电离平衡曲线如图所示,试回答下列问题:

(1)图中ABCDE五点的KW间的大小关系是___________.(用ABCDE表示)
(2)若从A点到D点,可采用的措施是______.
a.升温
b.加入少量的盐酸
c.加入少量的NaOH固体
(3)点B对应温度条件下,某溶液pH═7,此时,溶液呈____(酸性、碱性、中性),点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2= ___________.
-
已知水的电离平衡曲线如图示,试回答下列问题:
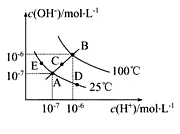
(1)图中五点Kw间的关系是 。
(2)若从A点到D点,可采用的措施是 。
A.升温 B.加入少量的盐酸 C.加入少量的N H4Cl
H4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。
(4)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L 混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=________________。
(5)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”“<”或“=”)。而溶液 中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=______ ___mol·L-1(填数据)
(6)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有 浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
-
已知水的电离平衡曲线如图所示,试回答下列问题:

(1)图中五点KW间的关系是__________________.
(2)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=2a,Va<Vb , 则a的取值范围为________.
-
已知水的电离平衡曲线如图示,试回答下列问题:
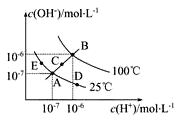
(1)图中五点Kw间的关系是_________。
(2)若从A点到D点,可采用的措施是_________。
A 升温 B 加入少量的盐酸 C 加入少量的NH4Cl
(3)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L 混合(设混合前后溶液的体积不变),所得混合溶液的pH=2,则 V1∶V2=________________。
(4)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”“<”或“=”)。而溶液 中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=________mol·L-1(填数据)
(5)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=____________mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
-
(10分)已知水的电离平衡曲线如图示,试回答下列问题:

(1)图中五点Kw间的关系是_________________。
(2)若从A点到D点,可采用的措施是________________________。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_________________。
(4)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=___________________。
(5)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值______________20.00(填“>”“<”或“=”)。而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为__________________________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=_______mol·L-1(填数据)
-
水的电离平衡曲线如图所示,根据图中数据,回答下列问题:

(1)图中A、B、C、D四点的Kw由大到小的顺序:________ 。
(2)若从A点到E点,可采用的方法是________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为_____ 。
(4)pH=12的氢氧化钠溶液温度由25℃高到100℃,pH=________ 。
-
(16分)I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题:

(1)图中A、B、C、D四点的  由大到小的顺序:______。
由大到小的顺序:______。
(2)若从A点到D点,可采用的方法是________________________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为____。
Ⅱ.(1)室温下,向氨水中加入稀盐酸,使其恰好完全中和,所得溶液的pH_______7(填“>”、“<”或“=”),用离子方程式表示其原因________________________,所得溶液中各离子物质的量浓度由大到小的顺序为____________;
(2)氨水中加入少量氯化铵固体,NH3.H2O的电离平衡_______(“向左”、“向右”或“不”)移动,此时溶液中 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
-
水的电离平衡曲线如图所示,下列说法错误的是( )

A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
-
水的电离平衡曲线如图所示,下列说法正确的是
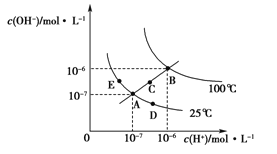
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
-
水的电离平衡曲线如图所示,下列说法不正确的是
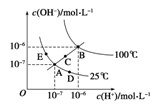
A.图中五点Kw的关系:B>C>A=D=E
B.若从A 点到D点,可采用:温度不变向水中加入少最的酸
C.若从A点到C点,可采用:温度不变向水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性

H4Cl
浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)






 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。

