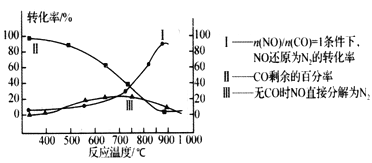
-
下列说法正确的是
A. 煤是由多种碳氢化合物组成的混合物
B. 聚酯纤维常用于生产服装面料,属于合成纤维
C. 青霉素有阻止多种细菌生长的优异功能,所以人人可以直接使用
D. 淀粉、纤维素和油脂都属于天然高分子化合物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在密闭容器中,使1molN2和3molH2充分反应后生成NH3的分子数为2NA
B. 标准状况下,0.56 L 丙烷中含有共价键的数目为0.2NA
C. 2g H218O和D2O 的混合物中,含有的中子数为NA
D. 若lmol 氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
难度: 困难查看答案及解析
-
关于有机物(
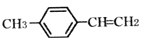 ) 的说法正确的是
) 的说法正确的是A. 该物质所有碳原子一定在同一平面
B. 在一定条件下能发生加成反应、氧化反应、取代反应、还原反应、加聚反应
C. 与该物质具有相同官能团的芳香烃的同分异构体有2种
D. 1mol该物质最多可与4mol H2 或1mol Br2 反应
难度: 中等查看答案及解析
-
X、Y、Z、W、R属于短周期元素.已知它们都不是稀有气体元素,X的原子半径最大,Y元素 的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m﹣n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1. 下列叙述错误的是
A. X与Y形成的两种化合物中阴、阳离子的个数比均为1:2
B. Y分别与Z、W、R以两种元素组成的常见化合物有5种
C. Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D. Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低
难度: 困难查看答案及解析
-
某小组研究Na2S 溶液与KMnO4溶液反应,探究过程如下
实验序号
I
II
实验过程
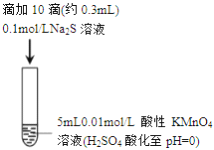
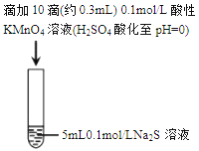
实验现象
紫色变浅(pH
1),生成棕褐色沉淀(MnO2)
溶液呈淡黄色(pH
8),生成浅粉色沉淀(MnS)
资料: i.MnO4-在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2
ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法正确的是
A. 根据实验可知,Na2S被还原
B. 取实验I中少量溶液进行实验,检测到有SO42-,得出S2-被氧化成SO42-
C. 实验I中反应离子方程式: 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
D. 实验II 中反应结束后溶液呈淡黄色,有MnO2生成
难度: 困难查看答案及解析
-
如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法不正确的是( )
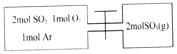
A. 第一次平衡时,SO2的物质的量左室更多
B. 入气体未反应前,左室压强和右室样大
C. 第一次平衡时,左室内压强一定小于右室
D. 第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
难度: 困难查看答案及解析
-
常温下,用20mL 移液管移取氨水至锥形瓶中,用0.05moL/LHCl溶液滴定。用pH计采集数据,电脑绘制的滴定曲线如下图所示。下列说法正确的是
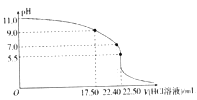
A. 当pH=11.0时,NH3•H2O的电离平衡常数Kb=1.78×10-5
B. 当pH=9.0 时,c(Cl-)>c(NH4+ )>c(OH-) >c(H+)
C. 当pH= 5.5时,溶液中有5 种微粒
D. 当pH= 7.0 时,氨水和HCl 溶液恰好完全反应
难度: 困难查看答案及解析
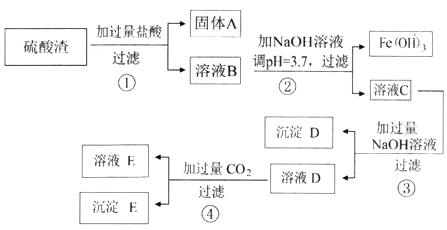
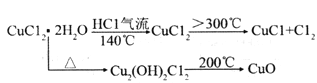
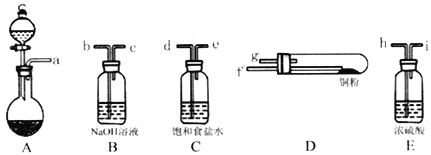
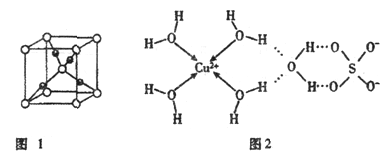
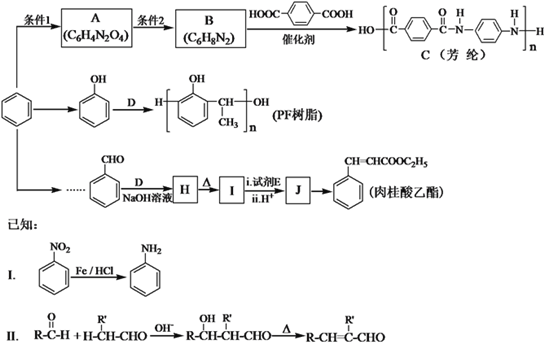 回答下列问题:
回答下列问题: