-
下列反应的离子方程式正确的是 ( )
A.铝粉投入到NaOH溶液中:2Al +2OH- = 2AlO2- + H2↑
B.铁粉加入三氯化铁溶液中:2Fe +Fe3+ = 3Fe2+
C.AlCl3溶液中加入足量的氨水:Al3+ + 3OH- = Al(OH)3↓
D. FeCl2溶液中加入氯水:Cl2 +2 Fe2+ =2 Fe3+ + 2Cl-
难度: 简单查看答案及解析
-
氢化钠(NaH)是一种白色晶体,其中钠为+1价,氢化钠和水反应放出氢气,下列叙述正确的是 ( )
A.NaH溶于水显酸性 B.NaH中氢离子最外层有2个电子
C.NaH中氢离子被还原成H2 D.NaH和水反应时,水为还原剂
难度: 简单查看答案及解析
-
下列实验操作正确的是:( )
A.可用氨水除去试管内壁上的银镜
B.硅酸钠溶液应保存在带有玻璃塞的试剂瓶中
C.锌与稀硫酸反应时,滴加少量硫酸铜可增大反应速率
D.将三氯化铁溶液蒸干,可制得无水三氯化铁
难度: 简单查看答案及解析
-
下列操作或仪器的选用正确的是 ( )

难度: 简单查看答案及解析
-
某温度下,炭和水蒸汽在密闭容器中发生下列反应: C(s)+H2O(g)
CO(g)+H2(g) , CO(g)+H2O(g)
CO2(g)+H2(g) 当反应达平衡时,测得[H2]=1.9mol/L,[CO2]=0.9mol/L,则CO的浓度为( )
A.0.1mol/L B. 0.9mol/L C. 1.8mol/L D. 1.9mol/L
难度: 简单查看答案及解析
-
对可逆反应2A(s)+3B(g)
C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
难度: 简单查看答案及解析
-
X、Y、Z、W有如图所示的转化关系,则X、W可能是( )
①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2
A.①②③ B.①② C.③④ D.①②③④
难度: 简单查看答案及解析
-
使用一种试剂,可以把KCl、AlCl3、Ba(NO3)2、CH3COOH四种溶液区别开来,所用试剂为( )
A、 NaOH B、BaCl2 C、Na2CO3 D、AgNO3
难度: 简单查看答案及解析
-
已知某温度下蒸馏水中的c(H+)=1×10-6mol/L,在此温度下将甲酸和氢氧化钠溶液混合,所得溶液的pH=7,此溶液中( )
A.c(HCOO-)<c(Na+) B.c(HCOO-)>c(Na+)
C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的关系
难度: 简单查看答案及解析
-
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为
CO(g)+ H2O(g)
CO2(g) + H2(g) △H <0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是 ( )
A 增加压强 B更换催化剂C 增大CO 的浓度 D降低温度
难度: 简单查看答案及解析
-
某同学为检验某溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是( )

A.原溶液中一定含有SO B.原溶液中一定含有NH
C.原溶液中一定含有Cl- D.原溶液中可能含有Fe3+
难度: 简单查看答案及解析
-
相同容积的四个密闭容器中进行同样的可逆反应:2A(g)+B(g)
3C(g)+2D(s),起始时四个容器所盛A、B的物质的量分别为:
甲
乙
丙
丁
A/mol
2
1
2
1
B/mol
1
1
2
2
在相同温度下建立平衡时,A或B的转化率大小关系正确的是( )
A.A的转化率:甲<丙=乙<丁 B.A的转化率:甲<乙<丙=丁
C.A的转化率:甲=丙<乙<丁 D.B的转化率::丁<乙<丙<甲
难度: 简单查看答案及解析
-
将CoCl2溶解于盐酸中可以形成CoCl,在溶液中存在下面的化学平衡:
Co2+(aq)+4Cl-(aq)
CoCl(aq) ΔH>0
粉红色 蓝色
下列说法正确的是 ( )
A.将盛有CoCl2和盐酸混合液的试管置于热水中,试管内溶液为红色
B.升高温度,正反应速率增大,逆反应速率减小
C.该反应的平衡常数K=
D.增大Cl-浓度,平衡向正反应方向移动,试管内溶液变为蓝色
难度: 简单查看答案及解析
-
同温度下的两种氨水A和B,A溶液的浓度是c mol/L,B溶液中c(NH4+)为c mol/L,则下列判断正确的是( )
A. A溶液氨水的电离程度大于B溶液氨水的电离程度
B. A溶液的c(OH-)小于B溶液的c(OH-)
C. A中水电离的c(OH-)小于B中水电离的c(OH-)
D. A溶液的pH大于B溶液的pH
难度: 简单查看答案及解析
-
在25 ℃时,将pH = 11的NaOH溶液与pH = 3的CH3COOH溶液等体积混合后,
下列关系式中正确的是( )
A.c(Na+) = c(CH3COO-)+c(CH3COOH)
B.c(H+)+ c(Na+) = c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 简单查看答案及解析
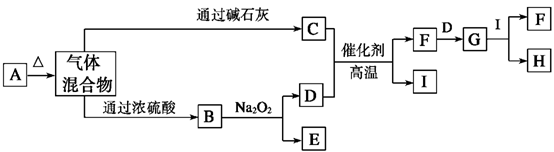 (1)A、F的化学式分别为________、 ________。
(1)A、F的化学式分别为________、 ________。