-
在多电子原子中,轨道能量是由以下哪些因素决定( )
①能层 ②能级 ③电子云的伸展方向 ④电子自旋状态
A. ①② B. ①④ C. ②③ D. ③④
难度: 简单查看答案及解析
-
下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是
①H2O ②NH3③F—④CN—⑤CO
A. ①② B. ①②③ C. ①②④ D. ①②③④⑤
难度: 中等查看答案及解析
-
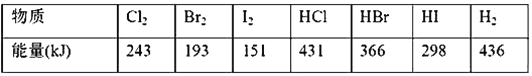
卤素单质从F2到I2,在常温、常压下的聚集状态由气态、液态到固态的原因是 ( )
A. 原子间的化学键键能逐渐减小
B. 范德华力逐渐增大
C. 原子半径逐渐增大
D. 氧化性逐渐减弱
难度: 简单查看答案及解析
-
在2p能级上最多只能排布6个电子,其依据的规律是
A. 能量最低原理 B. 泡利不相容原理
C. 洪特规则 D. 能量最低原理和泡利不相容原理
难度: 中等查看答案及解析
-
X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期,X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子的少1。下列说法正确的是( )
A. 原子半径由大到小的顺序为Z>Y>X
B. Y元素最高价氧化物对应的水化物的化学式为H3YO4
C. X的简单离子半径大于Y的简单离子半径
D. Ca2+的半径大于Y的简单离子半径
难度: 简单查看答案及解析
-
下面有关“核外电子的运动状态”的说法,其中错误的是( )。
A. 能级是描述电子运动的电子云形状
B. 只有在电子层、能级、电子云的伸展方向及电子的自旋状态都确定时,电子的运动状态才能被确定下来
C. 必须在B项所述四个方面都确定时,才能确定组成每一电子层的最多轨道数
D. 电子云伸展方向与能量大小是无关的
难度: 中等查看答案及解析
-
金属钛对人体体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关
和
的说法中正确的是( )
A.
和
的质量数相同,互称为同位素
B.
和
的质子数相同,互称为同位素
C.
和
的质子数相同,是同一种核素
D.
与
核外电子数相同,中子数不同,不能互称为同位素
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 第三周期所含的元素中钠的第一电离能最小
B. 铝的第一电离能比镁的第一电离能大
C. 在所有元素中,氟的第一电离能最大
D. 钾的第一电离能比镁的第一电离能大
难度: 中等查看答案及解析
-
下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )
A. K、Na、Li B. Al、Mg、Na
C. N、O、C D. Cl、S、P
难度: 中等查看答案及解析
-
有关甲醛分子的说法正确的是 ( )
①C原子采取sp杂化 ②甲醛分子为三角锥型结构
③C原子采取sp2杂化 ④甲醛分子为平面三角形结构
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
下列描述中正确的是( )
A. CS2为V形的极性分子
B. ClO3-的空间构型为平面三角形
C. SF6中有6对完全相同的成键电子对
D. SiF4和SO32-的中心原子前者为sp3杂化,后者为sp2杂化
难度: 中等查看答案及解析
-
下列各组表述中,两个粒子一定不属于同种元素原子的是
A. 3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B. M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C. 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D. 2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
难度: 中等查看答案及解析
-
把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏移的是( )
A.CCl4 B.C2H5OH C.CS2 D.C6H6
难度: 中等查看答案及解析
-
下列表示式错误的是( )
A. Na+的轨道表示式:
 B. Na+的结构示意图:
B. Na+的结构示意图:C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
难度: 中等查看答案及解析
-
下列图示中横坐标是表示元素的电负性数值,纵坐标表示同一主族的五种元素的序数的是( )
A.
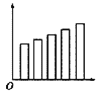 B.
B. 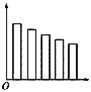
C.
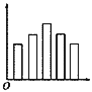 D.
D. 
难度: 简单查看答案及解析
-
下列关于价层电子对互斥模型(VSEPR模型)的叙述中不正确的是( )
A. VSEPR模型可用来预测分子的立体结构
B. 分子中价电子对相互排斥决定了分子的空间结构
C. 分子中键角越大,价电子对相互排斥力越小,分子越稳定
D. 中心原子上的孤电子对不参与互相排斥
难度: 简单查看答案及解析