-
下列与社会、生活有关的说法不正确的是
A.绿色化学的核心是从源头上防止和消除化工生产对环境的污染
B.减少化石燃料的使用,有利于降低空气中pM2.5的数值
C.“地沟油”禁止食用,但可以用来制柴油、肥皂等
D.淀粉、豆油、蛋白质都是天然高分子化合物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.25℃时,1 L pH =12的Ba( OH)2溶液中含有的OH-的数目为0.02 NA
B.常温常压下,19 g H30+含有10 NA个电子
C. l mol Fe与1 molCl2充分反应转移电子数为3NA
D.标准状况下,11.2 L乙醇所含的羟基数为0.5 NA
难度: 简单查看答案及解析
-
用下图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中
可行的是
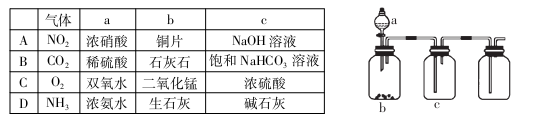
难度: 中等查看答案及解析
-
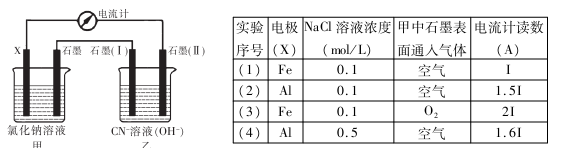
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是
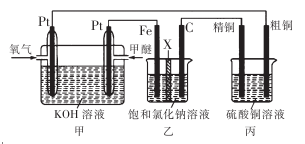
A.反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B.乙装置中铁电极为阴极,电极反应式为Fe - 2e - =Fe2+
C.通入氧气的一极为正极,发生的电极反应为O2 -4e - +2H2O -4OH -
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
难度: 困难查看答案及解析
-
下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是

难度: 困难查看答案及解析
-
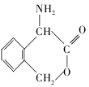
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖。右图是青蒿素的结构,则有关青蒿素的说法中不正确的是

A.青蒿素分子式为C15H22Os
B.青蒿素含有“-O-O-”键具有较强的氧化性
C.青蒿素易发生加成反应和氧化反应
D.青蒿素在碱性条件下易发生水解反应
难度: 中等查看答案及解析
-
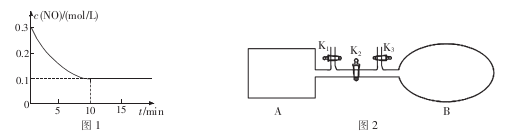
在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是
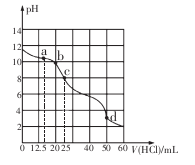
A.a点:c( HCO3-)>c(Cl-)>c(C032-)
B.b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH -)
C.c点:c(OH -)+c(CO32-)=c(H+)+c(H2CO3)
D.d点:c(Cl-)=c(Na+)
难度: 困难查看答案及解析


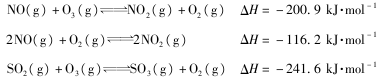







 的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。 )
)