-
下列说法不正确的是
A.氧化铝可用作耐火材料
B.向Na2CO3溶液中滴加醋酸溶液,一定有CO2气体生成
C.明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
D.Na2O2常用于潜水艇或呼吸面具的供氧剂
难度: 简单查看答案及解析
-
下列有关金属的说法正确的是
A.生铁与钢的区别在于生铁含碳杂质,而钢不含碳
B.铜在自然界中的含量高,所以铜是人类最早使用的金属
C.黑色金属材料包括铁、铝、锰及其化合物
D.金属一般都具有导电性、导热性、延展性
难度: 简单查看答案及解析
-
下列各组离子在溶液中能够大量共存的是
A.NH4+、Ca2+、OH﹣、HCO3﹣
B.Ag+、H+、SO32﹣、ClO﹣
C.NH4+、Br﹣、Na+、SO42﹣
D.H+、Cl﹣、Fe2+、NO3﹣
难度: 中等查看答案及解析
-
下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是
① 金属性最强的是锂
② 氧化性最强的是锂离子
③ 在自然界中均以化合态形式存在
④ Li的密度最大
⑤ 铯与水反应十分剧烈,甚至会发生爆炸
⑥ 粒子半径:Rb+>K+>Na+,Cs>Cs+
A.①②③ B.④⑤⑥ C.②④⑥ D.②③⑤⑥
难度: 中等查看答案及解析
-
下列保存物质的方法正确的是
A.保存液溴时向其中加入少量酒精,减少挥发
B.氢氟酸保存在塑料塞的玻璃瓶中,防止瓶口和塞子粘住
C.氨水易挥发,应密封在低温处保存
D.金属锂应保存在煤油中,防止被氧化
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.2.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.04NA
C.7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA
D.常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA
难度: 中等查看答案及解析
-
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时, a:b不可能为
A.3:4 B.4:5 C.2:3 D.3:2
难度: 困难查看答案及解析
-
下列与处理方法对应的反应方程式不正确的是
A.工业上用水吸收NO2生产硝酸: 3NO2 + H2O = 2HNO3 + NO
B.用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++ 3OH-= Fe(OH)3↓
C.用熟石灰处理泄漏的液氯:2Ca(OH)2 +2Cl2 = CaCl2 + Ca(ClO)2 +2H2O
D.用明矾除去水中的悬浮颗粒物:Al3++ 3H2O
Al(OH)3 (胶体) + 3H+
难度: 中等查看答案及解析
-
下列反应与Na2O2+SO2=Na2SO4相比较,Na2O2的作用相同的是
A. 2Na2O2+CO2=2Na2CO3+O2
B. 2Na2O2+2SO3=2Na2SO4+O2
C. Na2O2+H2SO4=Na2SO4+H2O2
D. 3Na2O2+Cr2O3=2Na2CrO4+Na2O
难度: 中等查看答案及解析
-
下图实验装置或操作正确的是
A
B
C
D
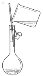
向容量瓶中转移液体
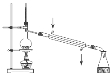
实验室制取蒸馏水
从饱和食盐水中提取NaCl晶体
分离酒精和水
难度: 简单查看答案及解析
-
下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1 nm~100 nm之间
B.用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D.树林中的晨曦,该现象与丁达尔效应有关
难度: 简单查看答案及解析
-
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案一:2.7g Al
X溶液
Al(OH)3沉淀
方案二:2.7g Al
Y溶液
Al(OH)3沉淀
NaOH溶液和稀盐酸的浓度均是3 mol/L,如图二是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是
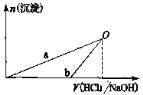
A.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2
B.b曲线表示的是向X溶液中加入NaOH溶液
C.在O点时两方案中所得溶液浓度相等
D.a、b曲线表示的反应都是氧化还原反应
难度: 困难查看答案及解析
-
向含1mol HCl和1mol MgSO4的混合溶液中加入1 mo1·L-1Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系如图三其中正确的是
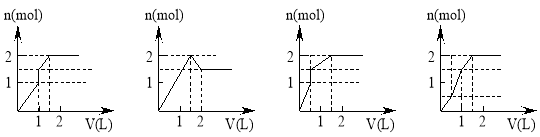
A. B. C. D.
难度: 困难查看答案及解析
-
某稀溶液中含有Fe(NO3)3 、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
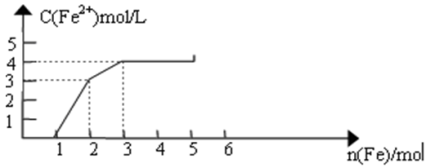
A. 1:1:4 B.1:3:1 C.3:3:8 D.1:1:1
难度: 困难查看答案及解析
-
FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是
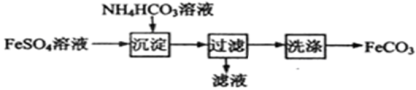
A.可利用KSCN溶液检验FeSO4溶液是否变质
B.沉淀过程中有CO2气体放出
C.过滤操作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D.产品FeCO3在空气中高温分解可得到纯净的FeO
难度: 中等查看答案及解析
-
下列说法不正确的是
A.为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法
B.原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极
C.白铁(镀锌铁)镀层破损后,铁皮依然受到保护
D.在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液
难度: 中等查看答案及解析
-
用于电动汽车的铝-空气燃料电池通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。则下列说法正确的是
A.以NaOH溶液为电解液时,负极反应为Al+3OH--3e-=Al(OH)3↓
B.以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-=4OH-
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
难度: 中等查看答案及解析
-
下列离子方程式或化学方程式与所述事实相符且正确的是
A.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH﹣=H2O
B.稀硝酸中加入过量铁粉:Fe+4H++NO3﹣═Fe3++NO↑+2H2O
C.表示硫酸与氢氧化钡反应的中和热的热化学反应方程式为:
1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l)△H=﹣57.3 kJ/mol
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42﹣完全沉淀:
Al3++2SO42﹣+2Ba2++4OH﹣=AlO2﹣+2BaSO4↓+2H2O
难度: 困难查看答案及解析
-
下列结论错误的是
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
A.只有① B.①③⑤ C.②④⑤⑥ D.①③
难度: 中等查看答案及解析
-
同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是
A. 2Na218O2 + 2H2O = 4Na18OH + O2↑
B. 2KMnO4 + 5H218O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 518O2↑ + 8H2O
C. NH3· 2H2O + HCl =NH4Cl + 2H2O
D. K37ClO3 + 6HCl = K37Cl + 3Cl2 ↑+ 3H2O
难度: 中等查看答案及解析
-
下图是部分短周期元素化合价与原子序数的关系图六,下列说法正确的是

A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物的碱性:Y<Z
难度: 中等查看答案及解析
-
下列化合物中所有化学键都是共价键的是
A.Na2O2 B.NaOH C.BaCl2 D.H2SO4
难度: 中等查看答案及解析
-
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1
C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
难度: 中等查看答案及解析
-
航天燃料从液态变为固态,是一项重要的技术突破。铍是高效率的火箭材料,燃烧时放出巨大的能量,已知1 kg金属铍完全燃烧放出的热量为62 700 kJ。则铍燃烧的热化学方程式正确的是
A.Be+
O2
BeO ΔH=-564.3 kJ·mol-1
B.Be(s)+
O2(g)
BeO(s) ΔH=+564.3 kJ·mol-1
C.Be(s)+
O2(g)
BeO(s) ΔH=-564.3 kJ·mol-1
D.Be(s)+
O2(g)
BeO(g) ΔH=-564.3 kJ·mol-1
难度: 中等查看答案及解析
-
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.③⑦⑧ B.③⑤⑧
C.①⑥⑦ D.⑤⑦⑧
难度: 中等查看答案及解析
-
如图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为
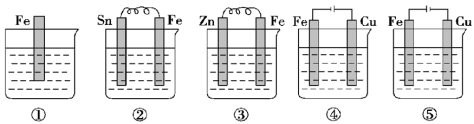
A.⑤②①④③ B.③②⑤④①
C.⑤④③②① D.⑤②①③④
难度: 中等查看答案及解析
-
结合图判断,下列叙述正确的是

A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
难度: 中等查看答案及解析
-
某充电宝锂离子电池的总反应为:xLi+Li1﹣xMn2O4
LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH
M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是
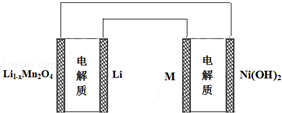
A.锂离子电池放电时Li+ 向正极迁移
B.锂离子电池充电时,阴极的电极反应式:LiMn2O4﹣xe﹣═Li1﹣xMn2O4+xLi+
C.如图九表示用锂离子电池给镍氢电池充电
D.镍氢电池放电时,负极的电极反应式:MH+OH--e-═H2O+M
难度: 中等查看答案及解析
-
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)
2C(g)达到平衡的标志的是
(1)C的生成速率与C的分解速率相等;
(2)单位时间内amol A生成,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5) B.(1)(3) C.(2)(7) D.(5)(6)
难度: 中等查看答案及解析
-
“类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈,性质更活泼的铝不能稳定存在于空气中
③Al(OH)3、Cu(OH)2受热易分解,Fe(OH)3受热也易分解
④不能用电解熔融的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁
A.①④ B.①②④ C.②④ D.①②③④
难度: 中等查看答案及解析