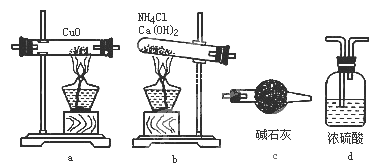
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是
A. a与其他三种元素形成的二元化合物中其化合价均为+1
B. b与其他三种元素均可形成至少两种二元化合物
C. c的原子半径是这些元素中最大的
D. d和a形成的化合物的溶液呈弱酸性
难度: 中等查看答案及解析
-
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A. 为提高农作物的产量和质量,应大量使用化肥和农药
B. 绿色化学的核心是应用化学原理对环境污染进行治理
C. 实现化石燃料清洁利用,就无需开发新能源
D. 垃圾是放错地方的资源,应分类回收利用
难度: 中等查看答案及解析
-
下列有关化学用语,使用正确的是
A. 氯原子的原子结构示意图:
B. NH4C1的电子式:

C. 原子核内有10个中子的氧原子:
O
D. 乙烯的结构式:CH2==CH2
难度: 简单查看答案及解析
-
下列关于常见有机物的说法不正确的是
A. 乙烯和苯都能与溴水反应
B. 乙酸和油脂都能与氢氧化钠溶液反应
C. 糖类和蛋白质都是人体重要的营养物质
D. 乙烯和甲烷可用酸性高锰酸钾溶液鉴别
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
难度: 困难查看答案及解析
-
苹果酸的结构简式为
,下列说法正确的是( )
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成1mol H2
D. HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体
难度: 中等查看答案及解析
-
COCl2 (g)
CO(g)+ Cl2(g) △H>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A. ①②④ B. ①④⑥ C. ②③⑥ D. ③⑤⑥
难度: 简单查看答案及解析
-
下列过程中吸收能量的是
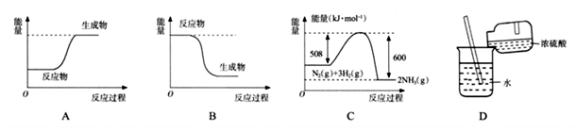
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列热化学方程式中,书写正确的是
A. 2SO2+O2
2SO3 △H =-196.6 kJ • mol-1
B. H2(g) +
O2(g)=H2O(l) △H =-285.8 kJ • mol-1
C. 2H2(g)+O2(g)=2H2O(l) △H =-571.6 kJ
D. C(s)+O2(g)=CO2(g) △H =393.5 kJ • mol-1
难度: 中等查看答案及解析
-
下列对检验方法或现象描述不正确的是( )
A. 乙烷中是否混有乙烯,可用通过溴水是否褪色进行检验
B. 乙醇中是否混有水,可用加硫酸铜粉末是否变蓝进行检验
C. 乙酸中是否混有乙醇,可用加入金属钠是否产生气体进行检验
D. 乙酸乙酯是否混有乙酸,可用加石蕊试液是否变红进行检测
难度: 中等查看答案及解析
-
可逆反应aA(g)+bB(g)
cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是( )

A. a+b>c+d T1>T2ΔH>0 B. a+b>c+d T1<T2ΔH<0
C. a+b<c+d T1>T2ΔH>0 D. a+b<c+d T1<T2ΔH<0
难度: 中等查看答案及解析
-
己知H-H键键能(化学键断裂时吸收或形成时释放的能量)为436 kJ/mol,N-H键键能为391 kJ/mol,根据热化学方程式:N2(g)+3H2(g)=2NH3(g) △H =-92.4 kJ/mol,可知 N≡N键的键能是
A. 431kJ/mol B. 946 kJ/mol C. 649 kJ/mol D. 896 kJ/mol
难度: 简单查看答案及解析
-
反应N2+3H2
2NH3,开始时N2的浓度为3 mol • L-1,H2的浓度为5 mol·L-1,3 min后测得NH3浓度为0.6 mol·L-1,则此时间内,下列反应速率表示正确的是
A. v(NH3) =0.2 mol • L-1 • s-1 B. v (N2) = 1.0 mol • L-1 • min-1
C. v (H2) =0.3 mol • L-1 • min-1 D. v (H2) =1.67 mol • L-1 • min-1
难度: 简单查看答案及解析
-
某烷烃的一种同分异构体只能生成一种一氯代物,则该烃的分子式不可能的是
A. C2H6 B. C4H10 C. C5H12 D. C8H18
难度: 中等查看答案及解析
-
对于可逆反应M+N
Q达到平衡时,下列说法正确的是
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. 反应物和生成物的浓度都保持不变
D. 正反应和逆反应不再进行
难度: 简单查看答案及解析
-
已知反应①:CO(g)+CuO(S)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
Cu(s)+H2O(g)
在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数为K,则下列说法正确的是
A. 反应①的平衡常数K1=
B. 反应③的平衡常数K=
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
难度: 中等查看答案及解析
-
下列物质之间的相互关系错误的是
A. CH3CH2OH和CH3OCH3互为同分异构体
B. 干冰和冰为同一种物质
C. CH3CH3和CH3CH2CH3互为同系物
D.
C和
C互为同位素
难度: 简单查看答案及解析
-
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
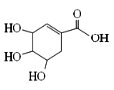
A. 分子式为C7H6O5
B. 分子中含有2种官能团
C. 可发生加成和取代反应
D. 在水溶液中羟基和羧基均能电离出氢离子
难度: 中等查看答案及解析
-
把1 molCO2和3 molH2通入1 L的密闭容器中,在某温度下发生反应:CO2(g) +3H2(g)
CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1 。测得 CO2和CH3OH 的浓度随时间的变化如图所示,下列说法正确的是
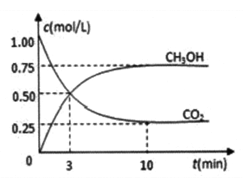
A. 3 min 时,V正=V 逆
B. 0~10 min内,H2的平均反应速率为2. 25 mol • L-l • min-1
C. 该温度下,反应的平衡常数K=5.3
D. 若升高温度,则CO2的转化率大于75%
难度: 中等查看答案及解析
-
在测定中和热的实验中,下列说法正确的是
A. 使用环形玻璃棒是为了加快反应速率,减小实验误差
B. 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C. 用0. 5 mol • L-1NaOH溶液分别与0. 5 mol • L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D. 在测定中和热实验中需要使用的仪器有天平、量简、烧杯、滴定管、温度计、环形玻璃搅拌棒
难度: 中等查看答案及解析
-
下列推断正确的是 ( )
A. 根据同浓度的两元素含氧酸钠盐(正盐)溶液的碱性强弱,可判断该两元素非金属性的强弱
B. 根据同主族两非金属元素氢化物沸点高低,可判断该两元素非金属性的强弱
C. 根据相同条件下两主族金属单质与水反应的难易,可判断两元素金属性的强
D. 根据两主族金属原子最外层电子数的多少,可判断两元素金属性的强弱
难度: 简单查看答案及解析
-
已知反应:3A(g)+B(g)
C(s)+4D(g) △H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况,下列分析正确的是

A. b曲线t2后,v正(B) =4v逆 (D)
B. a曲线t1时,4 v正(A) >3 v逆 (D)
C. 升高温度,可使曲线b变为曲线a
D. 缩小反应容器的体积,可使曲线a变为曲线b
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变会使反应速率加快的是
A. 增加 C的质量 B. 将容器的体积缩小一半
C. 保持体积不变,充入氦气使体系压强增大 D. 保持压强不变,充入氮气使容器体积增大
难度: 中等查看答案及解析
-
某容器中加入N2和H2,在一定条件下,N2+3H2
2NH3,达到平衡时N2、H2、NH3的浓度分别是3 mol • L-l、4 mol • L-1、4 mol • L-1,则反应幵始时H2的浓度是
A. 5 mol • L-1 B. 10 mol • L-1 C. 8 mol • L-1 D. 6.7 mol • L-1
难度: 简单查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是

A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中NO3-物质的量为0.4 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20 mL原混合酸加水稀释至1 L后溶液c(H+) =0.1mol • L-l
难度: 困难查看答案及解析