-
下列有关物质分类的说法中,正确的是( )
A. 烧碱、冰醋酸、石墨均为电解质
B. 液态HCl不导电,所以HCl不是电解质
C. BaSO4虽然难溶于水,但属于强电解质
D. NH3溶于水形成的溶液能导电,所以NH3是电解质
难度: 中等查看答案及解析
-
在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A. FeCl3+3KSCN
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B. 工业合成氨中,将氨气液化分离
C. A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B中试管中产生气泡快
D. 对于反应2NO2(g)
N2O4(g) △H<0,升高温度可使体系颜色变深
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A. 10 mL 20 mol•L﹣1浓硫酸与足量锌反应,转移电子数为 0.2NA
B. 0.1 mol24Mg18O 晶体中所含中子总数为 2.0 NA
C. 在标准状况下,2.8g N2 和 2.24L CO 所含电子数均为 1.4NA
D. 1 L 1 mol•L﹣1的 NaClO 溶液中含有 ClO﹣的数目为NA
难度: 中等查看答案及解析
-
下列离子反应方程式书写正确的是( )
A. Fe(OH)3 溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. 向 NaAlO2 溶液中通入过量 CO2:AlO2- +CO2+2H2O=Al(OH)3↓+HCO3﹣
C. 在强碱溶液中次氯酸钠与 Fe(OH)3 反应生成 Na2FeO4 :3ClO﹣+2Fe(OH)3=2FeO42- +3Cl﹣+H2O+4H+
D. 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2﹣=Al2S3↓
难度: 中等查看答案及解析
-
2 molA与2 molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
A. z=2 B. 2s后,容器内的压强是初始的7/8倍
C. 2s时C的体积分数为2/7 D. 2s后,B的浓度为0.5mol/L
难度: 困难查看答案及解析
-
下列关系的表述中,正确的是( )
A. 0.1mol•L﹣1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42﹣)+c(OH﹣)
B. 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C. pH=3的盐酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等
D. 0.1mol•L﹣1NaHCO3溶液中:c(Na+)>c(HCO3)>c(H2CO3)>c(CO32﹣)
难度: 简单查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH- △H>0,下列叙述正确的是( )
A. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B. 向水中加入氨水,平衡逆向移动,c(OH-)降低
C. 向水中加入固体硫酸铜,平衡逆向移动,c(OH-)减小
D. 将水加热,KW增大,pH不变
难度: 中等查看答案及解析
-
下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 某弱酸的酸式盐NaHA溶液中一定有:c(OH﹣)+2c(A2﹣)=c(H+)+c(H2A)
B. 0.2 mol•L﹣1 CH3COONa溶液与0.1 mol•L﹣1盐酸等体积混合后的酸性溶液中:c(CH3COO﹣)>c(CH3COOH)>c(Cl﹣)>c(H+)
C. 室温下,向100ml0.5mol/L的Na2CO3溶液中加入0.05molCaO,
溶液中增大
D. 0.1 mol•L﹣1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L﹣1
难度: 困难查看答案及解析
-
下列有关说法中正确的是( )
A. 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+ 2CO2(g)在低温下能自发进行,则该反应的△H<0
B. NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H <0
C. 若△H>0,△S<0,化学反应在任何温度下都能自发进行
D. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
难度: 简单查看答案及解析
-
下列各组物质混合、加热蒸干、并经充分灼烧,得到混合物的是( )
A. 0.1 mol•L﹣1 CH3COOH溶液与0.1 mol•L﹣1NaOH溶液等体积混合
B. 向40mL0.2 mol•L﹣1的NaOH溶液中通入67.2mLCO2(标况)
C. 在100mL1 mol•L﹣1NH4Cl溶液中,投入3.9gNa2O2
D. 在20mL0.01 mol•L﹣1Mg(HCO3)2溶液中,投入0.2g Mg(OH)2
难度: 简单查看答案及解析
-
在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系己达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是( )
A. 前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B. 在2s时体系内的压强为开始时的1.1倍
C. 在平衡时体系内N2O4的物质的量为0.25mol
D. 平衡时,N2O4的转化率为40%
难度: 中等查看答案及解析
-
下列混合溶液中,各离子浓度的大小顺序正确的是( )
A. 10 mL0.1 mol•L﹣1氨水与10 mL0.1 mol•L﹣1盐酸混合,c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
B. 10 mL0.1 mol•L﹣1NH4Cl溶液与5 mL0.2 mol•L﹣1NaOH溶液混合,则:c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+)
C. 10 mL0.1 mol•L﹣1CH3COOH溶液与5 mL0.2 mol•L﹣1NaOH溶液混合,则:c(Na+)=c(CH3COO﹣)>c(OH﹣)>c(H+)
D. 10 mL0.5 mol•L﹣1CH3COONa溶液与6 mL 1 mol•L﹣1盐酸混合,则:c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+)
难度: 中等查看答案及解析
-
常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )
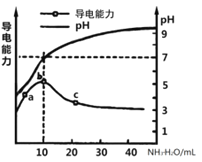
A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
难度: 困难查看答案及解析
-
某恒温密闭容器发生可逆反应Z(?)+W(?)
X(g)+Y(?),t1时刻达到平衡,t2时刻缩小容器体积,t3时刻再次达到平衡后未再改变条件,如图所示。下列说法正确的是
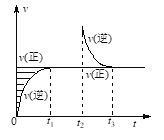
A. Z和W在该条件下至少有一种为气态
B. t1~ t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~ t2时间段与t3时刻后的X浓度不相等
D. 若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而增大
难度: 中等查看答案及解析
-
把0.02mol/L CH3COOH溶液和0.01mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A. c(CH3COO﹣)<c(Na+)
B. c(CH3COOH)>c(CH3COO-)
C. 2c(H+)=c(CH3COO﹣)﹣c(CH3COOH)
D. c(CH3COOH)+c(CH3COO﹣)=0.01mol/L
难度: 困难查看答案及解析
-
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2
2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
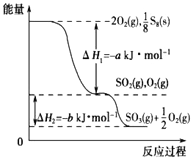
A. S8的燃烧热△H=﹣a kJ·mol﹣1
B. 1 mol SO2和过量 O2反应可释放出 b kJ 的热量
C. 已知1个S8分子中有8个S﹣S,S=O的键能为d kJ·mol﹣1,O=O的键能为e kJ·mol﹣1,则S8分子中S﹣S的键能为(2d﹣a﹣e) kJ·mol﹣1
D. 若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ
难度: 中等查看答案及解析
-
一定条件下存在反应:2SO2(g)+O2(g)═2SO3(g),△H<0.现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在400℃条件下开始反应.达到平衡时,下列说法正确的是( )

A. 容器Ⅰ、Ⅲ中平衡常数相同
B. 容器Ⅱ、Ⅲ中正反应速率相同
C. SO3的体积分数:Ⅱ<Ⅲ
D. 容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
难度: 困难查看答案及解析
-
已知常温下KHSO3溶液的pH<7,且等浓度的HSO3-的电离程度大于SO32-的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是
A.c(SO42-)>c(HSO3-)>c(SO32-) >c(H2SO3)
B.c(K+)>c(SO32-)>c(SO42-)>c(HSO3-)>c(H+)>c(OH-)
C.c(K+)=c(HSO3-)+2c(SO32-)+2c(SO42-)
D.c(K+)+c(H+)=c(HSO3-)+c(SO32-)+c(SO42-)+c(OH-)
难度: 困难查看答案及解析
-
在一定的温度下,将一定量的氢气和氮气的混合气体充入等压密闭容器中进行反应,达到平衡时维持温度不变,测得混合气体的密度是反应前密度的1.25倍,则达到平衡时,氨气的体积分数为( )
A. 25% B. 27.5 % C. 30% D. 37.5%
难度: 简单查看答案及解析
-
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的
,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2
N2O4(不考虑活塞的摩擦)下列说法中正确的是( )

A. 活塞从D处移动到C处的过程中,通入CO2体积为2.24L(标准状况)
B. NO2转化为N2O4的转换率为20%
C. 活塞移至C处后,继续通入0.01mol CO2,此时活塞恰好回到D处
D. 若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入CO2的量,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量应大于1.56g
难度: 困难查看答案及解析