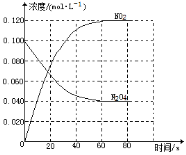
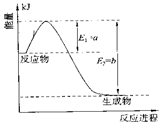
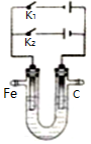
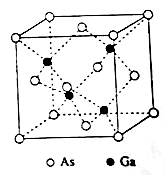
-
下列关于化学与生活的说法正确的是 ( )
A. 由SiO2构成的晶体有:水晶、玛瑙、石英晶体
B. 胶体的电泳现象的产生,是由于胶体带电,胶体在外加电场下可以定向流动
C. 明矾可用于自来水的净化和杀菌消毒
D. Fe3+与SCN-形成的配合物,常用于电影特技和魔术表演
难度: 中等查看答案及解析
-
下列有关物质性质的比较顺序中,不正确的是 ( )
A. 热稳定性:HF<HCl<HBr<HI B. 微粒半径:K+>Na+ >Mg2+>Al3+
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3 D. 第一电离能:Cl>P>S>Si
难度: 中等查看答案及解析
-
铝、铍( Be)及其化合物具有相似的化学性质。已知;BeCl2 +Na2BeO2 +2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是
A.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
B.BeCI2水溶液的导电性强,故BeCl2是离子化合物
C.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
D.BeCl2溶液的pH>7,将其蒸干并灼烧后得到的残留物可能是BeCl2
难度: 中等查看答案及解析
-
氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2―→2HCl +2COCl2。下列说法不正确的有
A.CHCl3分子的空间构型为正四面体
B.COCl2分子中中心C原子采用sp2杂化
C.COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D.使用前可用硝酸银稀溶液检验氯仿是否变质
难度: 中等查看答案及解析
-
下列有关说法不正确的是
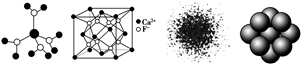
图1 图2 图3 图4
A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外的大多数电子在原子核附近运动
D. 金属Cu原子堆积模型如图4所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
难度: 困难查看答案及解析
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A. 元素的非金属性次序为c>b>a
B. a和其他3种元素均能形成共价化合物
C. d和其他3种元素均能形成离子化合物
D. 元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 简单查看答案及解析
-
下列说法错误的是( )
A. 常温下,pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小为③<②<①
B. 25℃时,PH=10的NaOH溶液和PH=10的Na2CO3溶液中水的电离程度相同
C. 常温下,若测得NaHA溶液的PH>7,则该溶液中一定有c(H2A)> c(A2-)
D. 0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合,该溶液中的各离子浓度符合此关系:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+)
难度: 困难查看答案及解析