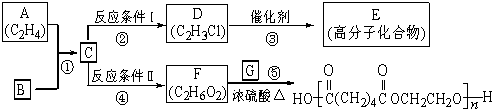
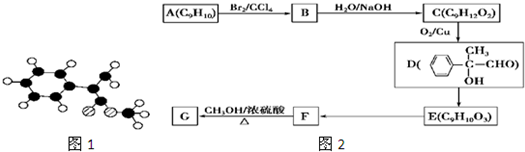
-
25℃时,水的电离达到平衡:H2O⇌H++OH-;△H>0,下列叙述正确的是( )
A.向水中加入氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变难度: 中等查看答案及解析
-
已知:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1
H2O(l)=H2O(g)△H2
C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
A.△H3=△H1+4△H2
B.△H3=△H1+△H2
C.△H3=△H1-4△H2
D.△H3=△H1-△H2难度: 中等查看答案及解析
-
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子多1.下列说法正确的是( )
A.元素X、Y的氢化物沸点Y的较高
B.Z元素最高价氧化物对应水化物的化学式可表示为HYO4
C.Y单质可在X的单质存在时燃烧产生化合物YX3
D.离子半径Z>Y难度: 中等查看答案及解析
-
100mL0.1mol•L-1 NaOH溶液与100mL0.1mol•L-1 CH3COOH溶液混合后,溶液中离子浓度关系正确的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+)+c(OH-)=c(CH3COO-)+c(H+)
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)难度: 中等查看答案及解析
-
2010年上海世博会是一次清洁能源技术的集中展示,其一是世博会的主要建筑都安装了太阳能光伏发电系统,系统引进了最先进的太阳能半导体薄膜,储藏阳光并转化为电能.下列叙述不正确的是( )
A.符合低碳、绿色、科技的世博理念
B.光伏发电系统是化学能转变为电能的装置
C.这种半导体材料主要是硅
D.核能、水力、风力、生物能(沼气)、海潮能等都是清洁能源难度: 中等查看答案及解析
-
下列有关化学用语正确的是( )
A.质量数为37的氯原子
B.乙烯的结构式CH2CH2
C.HCl的电子式为
D.N2的结构式 N≡N难度: 中等查看答案及解析
-
下列有机物命名正确的是( )
A.BrCH2-CH2Br 二溴乙烷
B.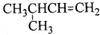 2-甲基丁烯
2-甲基丁烯
C.3,3,4-三甲基己烷
D.邻二甲苯
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.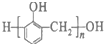 的合成单体有CH3OH
的合成单体有CH3OH
B.C4H8的同分异构体数为6
C.由氨基酸合成蛋白质主要进行的是加聚反应
D.重结晶和红外光普都是确定有机分子结构的现代物理方法难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.聚丙烯的结构简式为:
B.电石的化学式为:CaSiO3
C.热稳定性:H2S>HF
D.NH3的结构式为难度: 中等查看答案及解析
-
对
的表述不正确的是( )
A.能和盐酸、氢氧化钠反应
B.1mol能与3molBr2在苯环上发生取代反应
C.使FeCl3溶液显紫色
D.能与NaHCO3反应产生CO2难度: 中等查看答案及解析
-
把少量金属钠投入到的硫酸铜溶液中,下列叙述正确的是( )
A.析出金属铜
B.产生白色沉淀
C.产生红褐色沉淀
D.产生无色气体难度: 中等查看答案及解析
-
在NaCl溶液中滴加AgNO3溶液,再滴加KI溶液,下列描述正确的是( )
A.先产生白色沉淀后产生黄色沉淀
B.先产生白色沉淀后无明显现象
C.先产生黄色沉淀后产生白色沉淀
D.实验证明AgCl溶解度小于AgI溶解度难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LCH4中含有电子数目为8NA
B.14gCnH2n中含有的碳原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L0.5mol/LAlCl3 溶液中含有的Al3+数目为0.5NA难度: 中等查看答案及解析
-
下列有关金属铁的腐蚀与防护,说法正确的是( )
A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.铁与电源正极连接可实现电化学保护
D.将钢管与铜管一起堆放时可保护钢管少受腐蚀难度: 中等查看答案及解析
-
在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C
2AlN+3CO.下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2molAlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3
D.C被还原生成CO难度: 中等查看答案及解析
-
铜锌原电池如图工作时,下列叙述正确的是( )
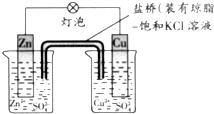
A.正极反应为:Zn-2e-=Zn2+
B.电池总反应为:Zn+2H+=Zn2++H2↑
C.盐桥主要作用是形成回路、中和两极电荷
D.盐桥中的Cl-移向CuSO4溶液难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓
B.用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑
C.利用腐蚀法制作印刷线路板:2Fe3++Cu═2Fe2++Cu2+
D.AgNO3溶液中加入过量氨水:Ag++NH3•H2O=AgOH↓+难度: 中等查看答案及解析
-
下列各组离子在给定条件下能大量共存的是( )
A.在pH=13的溶液中:NH4+、K+、ClO-、Cl-
B.有CO2-3存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有NO-3存在的强酸性溶液中:Ba2+、Fe2+、Cl-
D.在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO-2、K+难度: 中等查看答案及解析
-
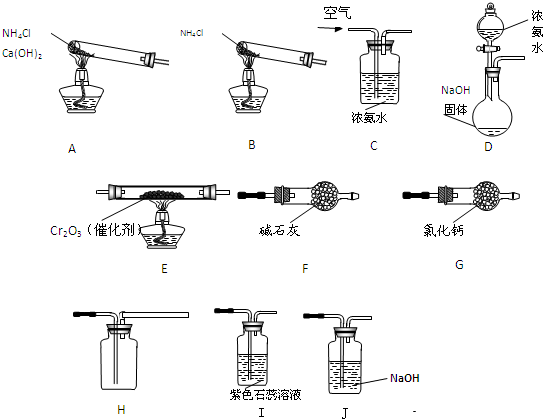
实验室制备Cl2通常采用下列反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;据此,从如图所示仪器装置中选择制备并收集干燥、纯净Cl2的装置是( )
A.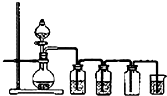
B.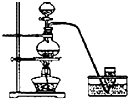
C.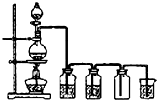
D.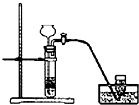
难度: 中等查看答案及解析
-
a、b、c是三种都含同一金属元素的物质,它们之间有如图所示的直接转化关系,则a、b、c是( )
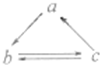
A.Na、Na2O、NaCl
B.Fe、FeCl3、FeCl2
C.Al、AlCl3、Al(OH)3
D.Cu、CuO、CuSO4难度: 中等查看答案及解析
-
一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)⇌2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为mol
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0,升高温度,平衡常数K减小难度: 中等查看答案及解析