-
金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
难度: 简单查看答案及解析
-
氢能是理想的清洁能源。下列制氢的方法中,最节能的是
A.电解水制氢:2H2O电解2H2↑+O2↑
B.高温使水分解制氢:2H2O高温2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O
2H2↑+O2↑
D.天然气制氢:CH4+H2O高温CO+3H2
难度: 简单查看答案及解析
-
矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn
2Au+Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是
A.Na[Au(CN)2]不溶于水
B.化合物Na[Au(CN)2]中金元素的化合价为+1
C.金元素在地壳中能以化合态的形式存在
D.在提炼过程中含金元素的物质始终作氧化剂
难度: 中等查看答案及解析
-
下列物质中,只含有离子键,不含有共价键的是
A.HCl B.KOH C.CaCl2 D.CO2
难度: 简单查看答案及解析
-
Se是人体必需微量元素,下列有关
Se和
Se的说法正确的是
A.
Se 和
Se所含电子数不同 B.
Se和
Se是两种不同的核素
C.
Se和
Se 分别含有44和46个质子 D.
Se和
Se都含有34个中子
难度: 简单查看答案及解析
-
正确掌握化学用语是学好化学的基础,下列有关表述正确的是
A.H、D、T互为同素异形体
B.氨分子中的化学键为非极性共价键
C.NH4Cl的电子式:
D.S2-的结构示意图:
难度: 简单查看答案及解析
-
元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满。若发现119号元素,请在“元素大厦”中安排好它的“房间”
A.第七周期0族 B.第六周期第ⅡA族
C.第八周期第ⅠA族 D.第七周期第ⅦA族
难度: 简单查看答案及解析
-
已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是
A.钡可从氯化钠溶液中置换出金属钠
B.钡可从冷水中置换出氢气
C.钡可从硫酸铜溶液中置换出铜
D.在溶液中Ba2+可氧化金属锌,生成Zn2+
难度: 简单查看答案及解析
-
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下:
N+
He―→
O+
H,下列叙述正确的是
A.
O原子核内有9个质子
B.
H原子核内有1个中子
C.O2和O3互为同位素
D.通常情况下,He和N2化学性质都很稳定
难度: 简单查看答案及解析
-
下列递变情况中,正确的是
A.Na、Mg、Al原子的最外层电子数依次减少 B.C、N、O的原子半径依次减小
C.Si、P、S元素的最高正化合价依次降低 D.Li、Na、K的金属性依次减弱
难度: 简单查看答案及解析
-
含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是
A.非金属性比硫强 B.氢化物比HBr稳定
C.原子序数为34 D.最高价氧化物的水化物显碱性
难度: 简单查看答案及解析
-
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:
HXO4>H2YO4>H3ZO4,则下列判断中正确的是
A.元素非金属性按X、Y、Z的顺序减弱
B.原子的电子能力按X、Y、Z的顺序增强
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.单质的氧化性按X、Y、Z的顺序增强
难度: 中等查看答案及解析
-
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
难度: 中等查看答案及解析
-
A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
难度: 中等查看答案及解析
-
在下列各说法中,正确的是
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
难度: 中等查看答案及解析
-
已知298 K时,合成氨反应N2(g)+3H2(g)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
A.一定小于92.0 kJ B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
难度: 简单查看答案及解析
-
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:
①Sn(白,s)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH1
②Sn(灰,s)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH2
③Sn(灰,s)
Sn(白,s)ΔH3=+2.1 kJ·mol-1
下列说法正确的是
A.ΔH1>ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏
难度: 中等查看答案及解析
-
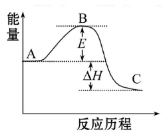
下列变化为放热的化学反应的是
A.H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
B.2HI(g)===H2(g)+I2(g)
ΔH=+14.9 kJ·mol-1
C.形成化学键时共放出862 kJ能量的化学反应
D.能量变化如右图所示的化学反应
难度: 简单查看答案及解析
-
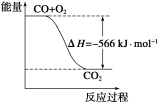
已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
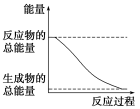
A.CO的燃烧热为283 kJ
B.下图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532kJ·mol-1
D.CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
难度: 困难查看答案及解析
-
白磷会对人体造成严重的烧伤,白磷(P4)分子结构为
。下列说法不正确的是
A.白磷着火点低,在空气中可自燃
B.白磷、红磷互为同素异形体
C.31 g白磷中,含P—P键1.5 mol
D.已知P4(白磷,s)+3O2(g)===2P2O3(s) ΔH=-Q kJ·mol-1,则白磷的燃烧热为Q kJ·mol-1
难度: 中等查看答案及解析