-
把镁条投入盛有盐酸的敞口容器中, 产生H2的速率可由下图所示,影响产生氢气反应速率的因素是( )
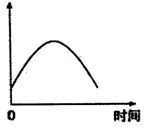
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.②③ D.①②③
难度: 简单查看答案及解析
-
某容积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B
2C。若维持温度和压强不变,当达到平衡时,容器容积为VL,其中C气体的体积占10 % ,下列推断正确的是( )
①原混合气体的体积为1.2L
②原混合气体的体积为1.1L
③反应达到平衡时气体A消耗掉0.05VL
④反应达到平衡时气体B消耗掉0.05VL
A.②③ B.②④ C.①③ D.①④
难度: 中等查看答案及解析
-
在下列过程中,需要增大化学反应速率的是( )
A.钢铁腐蚀 B.食物腐败 C.塑料老化 D.工业合成氨
难度: 简单查看答案及解析
-
决定化学反应速率的根本因素是( )
A.温度和压强 B.反应物的浓度
C.参加反应的各物质的性质 D.催化剂的加入
难度: 简单查看答案及解析
-
下列反应条件的控制中不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率,加入MnO2
D.为加快H2O2的分解速率, 把反应容器放到冷水中冷却
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.反应SiO2 (s) + 3C(s)=SiC(s)+2CO(g)室温下不能进行,则该反应的△H<0
B.铅蓄电池放电过程中,正极质量增加,负极质量减小
C.25 ℃下,在NH3·H2O稀溶液中,加水,
的值不变
D.在NaHS溶液中,滴入少量CuC12溶液产生黑色沉淀,HS-水解程度增大,pH增大
难度: 中等查看答案及解析
-
下列有关说法错误的是( )
A.为保护海轮的船壳,常在船壳上镶入锌块
B.纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应
C.已知工业合成氨气△H<0,达平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
D.NH3(g)+ HCl(g)= NH4Cl(s)较低温度下能自发进行,说明该反应的△H<0
难度: 简单查看答案及解析
-
下列措施肯定能使化学反应速率增大的是( )
A.增大反应物的量 B.增加压强 C.升高温度 D.使用正催化剂
难度: 简单查看答案及解析
-
下列说法正确的是:( )
A.在100℃、101kpa条件下,液态水的气化热为40.69kJ/mol,则H2O(g)
H2O(l)的△H=40.69kJ/mol
B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体的溶液中,都有c(Mg2+)=c(CO32-)=6.82×10-6
C.已知:
 ,则可以计算出反应
,则可以计算出反应 的△H为-384kJ/mol
的△H为-384kJ/molD.常温下,在0.10mol/L的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
难度: 中等查看答案及解析
-
下列能正确表示反应N2+3H2
2NH3建立平衡过程的图象是( )
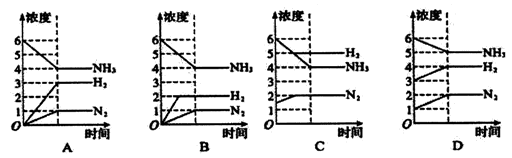
难度: 中等查看答案及解析
-
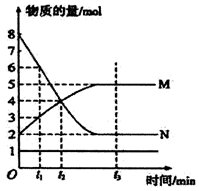
在一定温度下的可逆反应:mA(g)+nB(g)
pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间tl和t2的关系如下图所示,则下列关系正确的是()
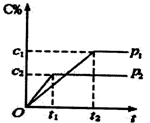
A.pl>p2 B.pl<p2 C.m+n>p+q D.m+n<p+q
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2 (g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
B.500℃、30MPa下,将0.5 molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热193kJ,其热化学方程式为:N2+3H2
2NH3(g) △H=-38.6kJ·mol-1
C.活化能的作用在于使反应物活化,所以化学反应的活化能不可能接近于零或等于零
D.常温下,反应C(s)+ CO2 (g)=2CO(g)不能自发进行,则该反应的△H>0
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.CaCO3 (s)=CaO(s)十CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀锌铁制品镀层受损后,铁制品比受损前更容易生锈
C.生铁中含有碳,抗腐蚀能力比纯铁强
D.Zn具有还原性和导电性,可用作碱性锌锰干电池的负极材料
难度: 中等查看答案及解析
-
某反应A+B
2C达到平衡时,增大压强,C的量减少,则下列结论符合该平衡的是()
A.A、B、C都是气体 B.A、B、C都是固体
C.B、C是气体,A是固体 D.A、C是气体,B是固体
难度: 中等查看答案及解析
-
下列措施肯定能使化学反应速率增大的是()
A.增加反应物的量 B.增大反应体系的压强
C .降低反应体系的温度 D.使用适宜的催化剂
难度: 简单查看答案及解析
-
在下列过程中,需要加快化学反应速率的是()
A.钢铁腐蚀 B.食物腐烂 C.工业炼钢 D.塑料老化
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g);△H<0 ,则该反应一定能自发进行
B.提取海带中碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好
C.原电池放电过程中,负极质量一定减轻,正极的质量一定增加
D.由于Ksp( MgCO3)< Ksp[Mg(OH)2],因此水垢中MgCO3会逐渐转化为Mg(OH)2
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.一定温度下,反应2Mg(s)+ CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0
D.常温下,向饱和Na2CO3 溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4)
难度: 中等查看答案及解析
-
实验室中欲加速制取氢气,最好的方法是用()
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应 D.粗锌(含铝、铜等杂质)与稀硫酸反应
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.放热反应在任何条件都能自发进行
B.应用盖斯定律,可计算某些难以直接测量的反应焓变
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g
难度: 简单查看答案及解析