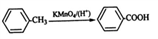-
中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果,下列古代文献对KNO3的叙述不合理的是
选项
目的
古代文献
说明
A
使用
“……凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”﹣《天工开物》
KNO3能自燃
B
鉴别
区分硝石(KNO3)和朴消(Na2SO4):“强烧之,紫青烟起,乃真硝石也”﹣《本草经集注》
利用焰色反应
C
提纯
“(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”﹣《开宝本草》
溶解、蒸发、结晶
D
性质
“(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”﹣《本草纲目》
利用KNO3的氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
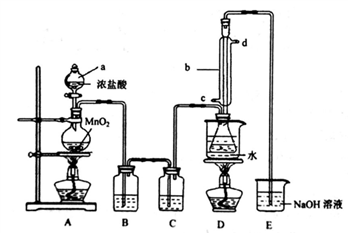
下列实验方案设计正确的是
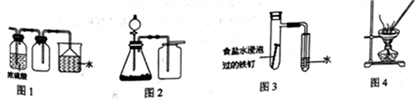
A. 利用图1收集干燥的氯化氢气体
B. 选择合适的试剂,利用图2可分别制取并收集少量CO2、NO和O2
C. 利用图3可验证铁发生吸氧腐蚀
D. 利用图4蒸干NH4Cl饱和溶液制备NH4Cl晶体
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 碳酸钙与醋酸反应:CO32-+ 2CH3COOH=CO2↑+ H2O+2CH3COO-
B. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
C. NaHCO3溶液显碱性:HCO3-+H2O=CO32-+H3O+
D. 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 中等查看答案及解析
-
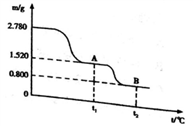
根据下图能量变化曲线判断,下列说法正确的是
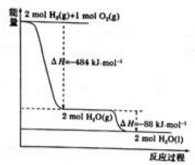
A. H2(g)+1/2O2(g)=H2O(l) △H=-242kJ·mol-1
B. 若H—H、O==O的键能分别是436 kJ·mol-1和496 kJ·mol-1,则H—O的键能是463 kJ·mol-1
C. 据图可知,氢气的燃烧热为242 kJ·mol-1
D. 10克氢气在氧气中完全燃烧,放出热量为1210kJ
难度: 中等查看答案及解析
-
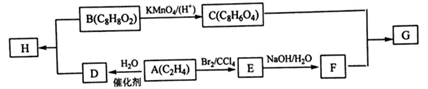
己知
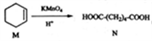 ,下列有关说法中正确的是
,下列有关说法中正确的是A. M中所有碳原子均位于同一平面,且与苯互为同系物
B. 与N含有相同官能团的同分异构体共有8种
C. M能发生加成反应和取代反应
D. N与乙醇发生酯化反应,生成物的分子式一定为C8H14O4
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层 电子数是电子层数的2倍,Y 与Z 能形成Z2Y、Z2Y2 型离子化合物, Z 与T形成的化合物Z2T。下列推断错误的是

A. 形成的简单离子半径的大小顺序为T>Y>Z
B. Z2Y、Z2Y2所含有的化学键类型相同
C. 0.005mol·L-1T的最高价氧化物对应水化物的水溶液pH等于2
D. Z2T的水溶液显碱性,对水的电离有促进作用
难度: 中等查看答案及解析
-
已知常温下浓度为0.1 mol·L-1的下列溶液的pH如下表所示:
溶质
NaF
NaClO
Na2CO3
pH
7.5
9.7
11.6
下列有关说法正确的是
A. 根据上表得出三种酸电离平衡常数的大小关系为:HF>HClO>H2CO3(一级电离平衡常数)
B. 加热0.1mol·L-1 NaClO溶液其pH,PH小于9.7
C. pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)=c(F-)>c(H+)=c(OH-)
D. 0.1 mol·L-1 Na2CO3溶液中,存在的关系:c(OH-)-c(H+)= c(HCO3-)+2c(H2CO3)
难度: 困难查看答案及解析
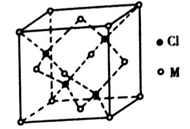
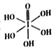 )和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____ HIO4(填“>”、“<”或“=”)。H5IO6中σ键与π键的个数比为________。
)和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____ HIO4(填“>”、“<”或“=”)。H5IO6中σ键与π键的个数比为________。