-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.硅是当前人类将太阳能转换为电能的常用材料
B.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化
C.生铁浸泡在食盐水中发生析氢腐蚀
D.胶体与溶液的分离可用渗析的方法
难度: 中等查看答案及解析
-
下列说法正确的是
A.已知KCl与MgO的晶体结构跟NaCl的晶体结构相似,则晶体的熔点:MgO>KCl>NaCl
B 向滴有酚酞的碳酸钠溶液中加入BaCl2溶液,溶液褪色
C.分散系中分散质粒子的直径:Fe(OH)3胶体>Fe(OH)3悬浊液>FeCl3溶液
D.Na2O、MgO、Al2O3均属于碱性氧化物
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是
A.硫化亚铁溶于足量的稀硝酸中:FeS + 2H+ = Fe2+ + H2S↑
B.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++SO42—+Ba2++OH—=BaSO4↓+ H2O
C. 向溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:
HCO3- + Ba2+ + OH- = BaCO3↓+ H2O
难度: 困难查看答案及解析
-
下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。
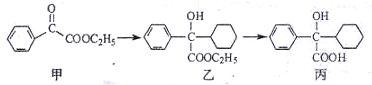
下列说法正确的是
A.化合物甲的分子式为C10H10O3,分子中的含氧官能团有醛基和酯基
B.化合物乙能发生消去反应,且生成的有机物能和溴发生加成反应
C.化合物乙与NaOH水溶液在加热条件下反应生成化合物丙
D.化合物丙能和氯化铁溶液发生显色反应
难度: 中等查看答案及解析
-
下列各组物质中,物质之间通过一步反应就能实现图示变化的是
物质编号
物质转化关系
a
b
c
d
①
FeCl2
FeC13
Fe
CuCl2
②
NO
NO2
N2
HNO3
③
Na2O
Na2O2
Na
NaOH
④
Al2O3
NaAlO2
Al
Al(OH)3
A.①④ B.①②③ C.①③④ D.②④
难度: 中等查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是
A.pH=4的0.1 mol·L-1的NaHC2O4溶液中:c(HC2O4-)>c (H2C2O4)>c(C2O42-)
B.0.1 mol·L-1的NaHCO3溶液中:c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
C.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl—)=c(CH3COOH)
D.常温下,等物质的量浓度的三种溶液:①(NH4)2SO4 ②NH4Cl ③(NH4)2Fe(SO4)2中c(NH4+):①<②<③
难度: 困难查看答案及解析
-
一定温度下,在一固定体积的容器中,通人一定量的CO和H2O,发生如下反应:CO(g)十H2O(g)
CO2(g)十H2 (g) △H<0。在850℃时,CO和H2O浓度变化如下左图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。下列说法正确的是:

A.850℃时,按左图所示0~4min用CO2表示的平均反应速率v(CO2)=0.02mol·L-1·min-1
B.t1℃高于850℃
C.t1℃时,反应在4min~5min间,平衡向逆反应方向移动,若其它条件不变,可能的原因是增大压强
D.若t2℃时,各物质的平衡浓度符合c(CO2)·c(H2)=2 [c(CO)·c(H2O)],则t2℃高于850℃
难度: 困难查看答案及解析
-
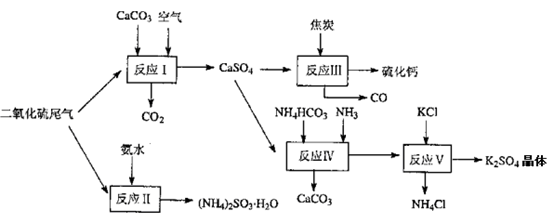
TiO2在工业生产和日常生活中有重要用途。
(1)工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
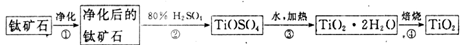
其中,步骤②发生的主要反应为:2H2SO4+FeTiO3 == TOSO4(硫酸氧钛)+FeSO4+2H2O
净化钛矿石时,需用浓氢氧化钠溶液来处理。写出该过程中发生反应的化学方程式:________________。
步骤③中加热的目的是(请写出必要的化学方程式和文字):________。
(2)用TiO2制备金属钛的一种方法是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2(s)+2Cl2(g)
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
已知:C(s)+O2(g)=CO2(g) △H=
394 kJ/mol。
则TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) △H=________
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因是_______________。
(3)下图是一种染料敏化太阳能电池的示意图。电池的一个由有机光敏染料(S)涂覆TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
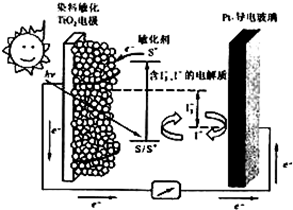
TiO2/S
TiO2/S* (激发态)
TiO2/S*
TiO2/S+ + e-
I3-+2e-
3I-
2TiO2/S*+I3-
2TiO2/S + I3-
下列关于该电池叙述正确的是________
A.电池工作时,I-离子在镀铂导电玻璃电极上放电
B.电池工作时,是将太阳能转化为电能
C.电池的电解质溶液中I-和I3- 浓度不会减少
D.电池中镀铂导电玻璃为正极
难度: 简单查看答案及解析