-
为证明化学反应有一定的限度,进行如下探究活动:
I.取5m1 0.1mol/L的KI溶液,滴加“滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)
Ⅱ.继续加入2ml CCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为_____________________________________________
探究活动Ⅱ的实验现象为_______________________________________________
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6] 4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息。现设计以下实验方案验证猜想:
①请完成下表
实验操作
现象和结论
步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6]
若_________,则猜想一不成立。
步骤二:往探究Ⅲ所得溶液中加入少量乙
醚,充分振荡、静置分层
若乙醚层呈血红色,则___________。
②写出实验操作“步骤—"中反应的离子方程式:_______________________________。
Ⅳ.为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液作指示剂,再用c mol/L KI标准溶液 滴定,达到滴定终点时的现象是_______________________________________________。
②重复滴定三次,平均耗用c mol/L KI标准溶液V mL,则FeCl3稀溶液物质的量浓度为________mol/L。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______ (填“偏高”或“偏低,,或“不变”)。
高三化学实验题中等难度题查看答案及解析
-
为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1mol•L-1的KI溶液,滴加0.1mol•L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为______、______.
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想.
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
②写出操作“步骤一”中发生反应的离子方程式______.实验操作 现象 结论 步骤一:______ 产生蓝色沉淀 ______ 步骤二:______ ______ “猜想二”成立 高三化学解答题中等难度题查看答案及解析
-
为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5—6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置。
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液。
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点。重复滴定三次,平均耗用c mol/LKI标准溶液VmL。
(1)探究活动I中发生反应的离子方程式为________。
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置。
。
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4—反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高。
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
实验操作
现象和结论
步骤一:
若产生暗蓝色沉淀,则________。
步骤二:
若乙醚层呈红色,则________。
②写出实验操作“步骤一”中的反应离子方程式:________。
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为________mol/L。
高三化学实验题极难题查看答案及解析
-
(15分)
为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_____________、________。
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
实验操作
现象
结论
步骤一:
产生蓝色沉淀
步骤二:
“猜想二”成立
②写出操作“步骤一”中发生反应的离子方程式________
高三化学实验题简单题查看答案及解析
-
为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_____________、___________。
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
实验操作
现象
结论
步骤一:
产生蓝色沉淀
步骤二:
“猜想二”成立
②写出操作“步骤一”中发生反应的离子方程式______________________
高三化学实验题中等难度题查看答案及解析
-
某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I-
2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是_____________________________;在不改变反应物用量的前提下,改进的方法是_____________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是______________________________。
(3)控制适合的条件,将反应2Fe3++2I-
2Fe2++I2,设计成如图所示的原电池。
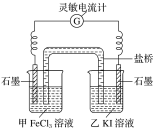
①反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为_________________________。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作_______(填“正”或“负”)极,该电极的电极反应式为_________________________。
高三化学实验题中等难度题查看答案及解析
-
下列设计的实验方案能达到相应实验目的的是( )
选项
实验目的
实验方案
A
探究化学反应的限度
取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
B
探究浓度对化学反应速率的影响
用两支试管各取5mL 0.1mol/L的KMnO4溶液,分别加入2mL 0.1mol/L和 0.2mol/L的H2C2O4(草酸
溶液,记录溶液褪色所需的时间
C
证明乙醇的消去反应有乙烯生成
将含有浓硫酸的乙醇溶液迅速升温至170℃,将产生的气体直接通入酸性KMnO4溶液中
D
验证醋酸钠溶液中存在水解平衡
取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体
其水溶液呈中性
,观察溶液颜色变化
A.A B.B C.C D.D
高三化学单选题中等难度题查看答案及解析
-
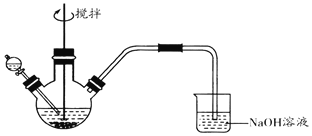
化学小组探究FeCl3溶液与Na2S溶液的反应产物,利用图装置进行如下实验:
Ⅰ.向盛有0.1 mol•L-1FeCl3溶液的三颈瓶中,滴加一定量0.1 mol•L-1Na2S溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有0.1 mol•L-1 Na2S溶液的三颈瓶中,滴加少量0.1mol•L-1 FeCl3溶液,搅拌,产生沉淀B。
已知:①FeS2为黑色固体,且不溶于水和盐酸。②Ksp(Fe2S3)=1×10-88,Ksp(FeS2)=6.3×10-31,Ksp[Fe(OH)3]=1×10-38,Ksp(FeS)=4×10-19
回答下列问题:
(1)NaOH溶液的作用是______。
小组同学猜测,沉淀A、B可能为S、硫化物或它们的混合物。他们设计如下实验进行探究:
实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:
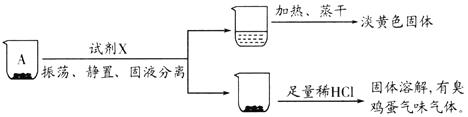
(2)试剂X是______。由此推断A的成分是______(填化学式)。
实验二、探究B的成分
取沉淀B于小烧杯中,进行如下实验:

(3)向试管a中加入试剂Y,观察到明显现象,证明溶液中存在Fe2+.试剂Y是______,明显现象是______。由此推断B的成分是______(填化学式)。
(4)请分析Ⅱ中实验未得到Fe(OH)3的原因是______。
高三化学实验题中等难度题查看答案及解析
-
下列设计的实验方案能达到实验目的的是
A.工业上制取漂白粉:向澄清石灰水中通入足量的Cl2
B.验证醋酸是弱电解质:常温下测定0.1 mol·L-1醋酸钠溶液的pH
C.探究FeCl3和KI溶液反应限度:向5mL0.1 mol·L-1 FeCl3溶液中加入0.1 mol·L-1KI溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象
D.检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象
高三化学选择题中等难度题查看答案及解析
-
将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉 B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液 D.加入Ba(NO3)2溶液
高三化学单选题中等难度题查看答案及解析