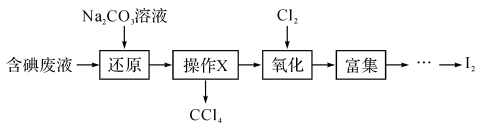
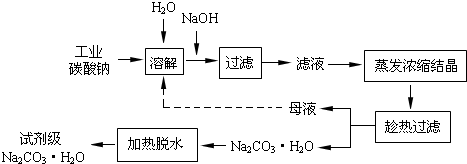
-
生活中处处有化学,下列表述错误的是
A.低碳生活的核心就是节约能源,减少温室气体的排放
B.硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
C.PM2.5含有铅、铬、镉、钒、砷等元素均为对人体有害的金属元素
D.变质的植物油有难闻的特殊气味,是由于植物油发生了氧化反应
难度: 简单查看答案及解析
-
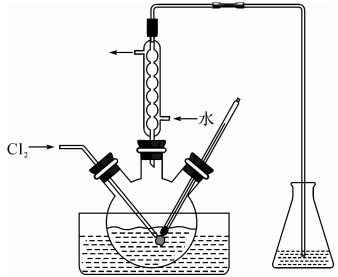
实验是研究化学的基础,下图中所示的制备实验方法、装置或操作均正确的是
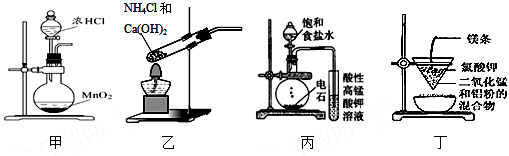
A.可用装置甲制取氯气 B.可用装置乙制取氨气
C.可用装置丙制取并检验乙炔 D.可用装置丁制得金属锰
难度: 中等查看答案及解析
-
某有机物A的结构简式如图,下列有关A的说法正确的是( )
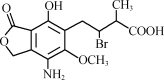
A.分子式为C14H25O6NBr
B.该分子中含有两个手性碳原子
C.不能使酸性高锰酸钾溶液褪色
D.A在一定条件下与氢氧化钠溶液反应,1 mol A最多消耗3 mol NaOH
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是
A. 2 mol·L-1 NaCl溶液中含有Na+个数为2NA
B. 标准状况下,22.4 L H2O含有的水分子数为NA
C. 71 g氯气与足量铁粉充分反应,转移的电子数为3NA
D. 标准状况下,16 g O2和O3的混合气体中原子的物质的量为1mol
难度: 中等查看答案及解析
-
以熔融CaF2-CaO作电解质,用如图5所示装置获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是
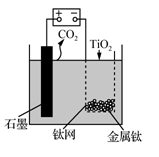
A. 整套装置工作前后CaO的总量不变
B. 阳极上电极反应式为2Ca2++4e-= 2Ca
C. 石墨电极作阳极,质量不变
D. 电解过程中,F-和O2-向阴极移动
难度: 困难查看答案及解析
-
短周期元素W、X、Y、Z的原子序数增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q具有漂白性,s在常温下为密度比水大且难溶于水的液体。0.01 mol/L r溶液的pH为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是
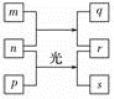
A. 原子半径的大小:W<X<Y
B. 元素的非金属性:Z>X>Y
C. Y的氢化物常温常压下为气态
D. X的最高价氧化物的水化物为弱酸
难度: 中等查看答案及解析
-
25℃时,几种物质的电离平衡常数如下表:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=3.0×10-8
下列叙述正确的是
A. HClO的漂白性是因为酸性很弱
B. 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大
C. 反应 2C1O- +CO2+H2O=CO32-+2HClO可以发生
D. 稀释醋酸溶液,则
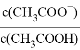 的数值随水量的增加而增大
的数值随水量的增加而增大难度: 中等查看答案及解析