-
化学与生产、生活密切相关。下列叙述错误的是
A.热的纯碱溶液可用于洗涤物品表面油污
B.药皂中加入苯酚,可以起到杀菌消毒的作用
C.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
D.假酒会对人体造成伤害,有毒成分主要是甲醇
难度: 中等查看答案及解析
-
下列化学用语正确的是
A.羟基的电子式:
B.核内有10个中子的氧原子:
C.乙醛的结构简式:CH3COH
D.碳原子的轨道表示式:
难度: 中等查看答案及解析
-
据报道,用10B合成的10B20有较好的抗癌作用。下列叙述正确的是
A.10B20是一种新型化合物 B.10B的中子数和核外电子数相等
C.10B20晶体熔点高,硬度大 D.10B和10B20互为同位素
难度: 中等查看答案及解析
-
下列现象能用键能大小解释的是
A.稀有气体一般很难发生化学反应 B.常温常压下,溴呈液态
C.氮气的化学性质比氧气稳定 D.硝酸容易挥发,而硫酸很难挥发
难度: 中等查看答案及解析
-
“地沟油”是指在生活中存在的各类劣质油脂,下列将“地沟油”变废为宝的各种方案中一定不能实现的是
A.发酵生产乙醇、沼气 B.分馏获得汽油、煤油
C.水解制造肥皂、甘油 D.转化成工业润滑油
难度: 中等查看答案及解析
-
元素性质的周期性变化不包括
A.原子半径 B.元素的主要化合价
C.原子核外电子结构 D.金属性和非金属性
难度: 简单查看答案及解析
-
有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
难度: 中等查看答案及解析
-
下列各组物质的性质比较中,正确的是
A.热稳定性:H2O>HF>H2S B.沸点:HF>HCl>HBr
C.密度:CH3CH2CH2Cl>CH3CH2Cl>CH3Cl D.氧化性:Fe3+>Cu2+>H+
难度: 中等查看答案及解析
-
五颜六色的变化增添了化学的魅力。下列有关反应的颜色变化叙述:
①新制氯水久置后→无色;②淀粉溶液遇单质碘→蓝色;③溴化银见光分解→银白色;④热的氧化铜遇乙醇→红色;⑤硝酸银溶液和碘化钾溶液产生沉淀→黄色;⑥苯酚在空气中被氧化→粉红色。其中正确的是
A.①②④⑤⑥ B.②③④⑤⑥ C.①②③④⑤ D.①④⑤⑥
难度: 中等查看答案及解析
-
将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
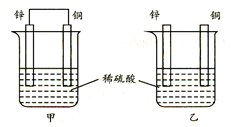
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极, 电极反应:Zn-2e→Zn2+
C.两烧杯中的pH值均增大
D.产生的气泡速率甲比乙慢
难度: 中等查看答案及解析
-
为了除去括号中的杂质,采用的试剂和方法均为正确的是
选项 物质 加入试剂 方法
A. 甲苯(苯酚) 浓溴水 过滤
B. 溴乙烷(溴单质) 热氢氧化钠溶液 分液
C. 乙酸乙酯(乙酸) 饱和碳酸钠 过滤
D. NaOH(s)(少量NaCl) 水 重结晶
难度: 中等查看答案及解析
-
已知:乙醇可被强氧化剂氧化为乙酸。BrCH2CH=CHCH2Br可经三步反应制取HOOCCH(Cl)CH2COOH,发生反应的类型依次是
A.水解反应、加成反应、氧化反应 B.加成反应、水解反应、氧化反应
C.水解反应、氧化反应、加成反应 D.加成反应、氧化反应、水解反应
难度: 中等查看答案及解析
-
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是
A.少量Na2SO4固体,v(H2)减小 B.VmLBaCl2溶液,v(H2)不变
C.加入细小的碳粒,v(H2)增大 D.加入NH4HSO4固体,v(H2)不变
难度: 中等查看答案及解析
-
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病。其转化过程如下:
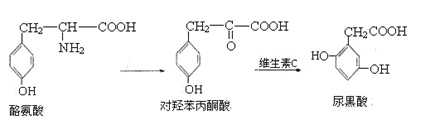
下列说法错误的是
A.1mol酪氨酸能与含1molHCl的盐酸反应,又能与含2molNaOH的溶液反应
B.酪氨酸能发生加成、取代、消去和缩聚反应
C.1mol对羟苯丙酮酸最多可与4molH2反应
D.1mol尿黑酸最多可与含3molBr2的溶液反应
难度: 困难查看答案及解析
-
对于常温下pH为1的硝酸溶液,下列叙述正确的是
A.该溶液lmL稀释至1000mL后,pH等于3
B.该溶液中水电离出的
是pH为3的硝酸中水电离出的
的100倍
C.该溶液中硝酸电离出的
与水电离出的
之比值为
。
D.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
难度: 中等查看答案及解析
-
标准状况下,将2.24LNH3通入1L 0.1mol/L的甲酸溶液中,欲确定所得溶液中NH4+、HCOO-、H+和OH-浓度大小顺序,通过下列数据即可得出正确结论的是
①NH3·H2O和HCOOH的电离常数②NH3·H2O和HCOONH4的电离常数③溶液的pH
A.不需任何数据 B.必需知道①、②、③三组数据
C.只需知道①、③中的任一组数据 D.只需知道①、②、③中的任一组数据
难度: 中等查看答案及解析
-
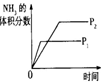
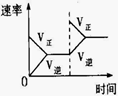
某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)
2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是

A.30min时降低温度,40min时升高温度
B.40min~54min之间反应速率v(正) < v(逆)
C.设20min和30min时的平衡常数分别为K1和K2,则K1 >K2
D.0~8minA的平均反应速率为0.64mol/(L·min)
难度: 中等查看答案及解析
-
下列各组物质,只用水就能加以区分的是
A.溴蒸汽、二氧化氮两种气体 B.己烯、甲苯、四氯化碳三种液体
C.溴苯、苯、乙醛三种液体 D.氯化钠、氯化铁、氯化钾三种固体
难度: 中等查看答案及解析
-
某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是

A.钠着火剧烈燃烧产生苍白色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气未被碱液完全吸收
难度: 中等查看答案及解析
-
下列实验过程中产生的现象与对应的图形正确的是
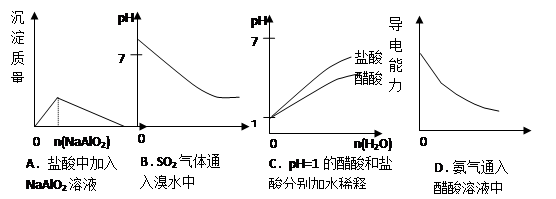
难度: 中等查看答案及解析
-
已知酸性
>H2CO3>
>HCO3―,向Na2CO3溶液中逐滴加入水杨酸(
)溶液,可能发生的反应的离子方程式书写正确的是
A.
+CO32―→
+HCO3―
B.
+CO32―→
+HCO3―
C.2
+CO32―→2
+CO2↑
D.3
+2CO32―→3
+HCO3―+H2O+CO2↑
难度: 中等查看答案及解析
-
HF气体分子间容易缔合。某HF气体由HF、(HF)2、 (HF)3三者混合而成,其平均相对分子质量为42,则(HF)3的体积分数可能为
A.51% B. 56% C.49% D.10%
难度: 中等查看答案及解析
-
矿物白云母是一种重要的化工原料,其化学式的氧化物形式为
K2O·3Al2O3·6SiO2·2H2O。就其组成元素完成下列填空:
(1)原子最外层有两个未成对电子的元素有_______;属于第三周期的非金属元素是______。
(2)上述元素中,形成的简单离子的半径由大到小的顺序为(Si除外)______________(填离子符号)。
(3)两种金属元素中,金属性较强的元素是_____,能说明这一事实的化学方程式是________(任写一个)。
(4)Al的最高价氧化物对应水化物在酸性溶液中的电离方程式为______________________。
难度: 中等查看答案及解析