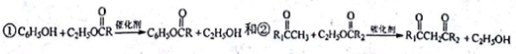-
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B
次氯酸盐具有氧化性
漂白粉漂白织物
C
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
D
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
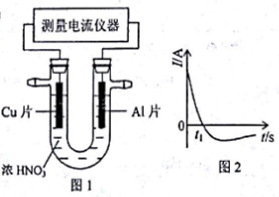
下列叙述正确的是
A. 1molH2燃烧放出的热量为H2的燃烧热
B. 某吸热反应能自发进行,因此该反应是熵增反应
C. 向饱和硼酸溶液中滴加Na2CO3溶液,有CO2气体生成
D. 原电池中发生的反应达平衡时,该电池仍有电流产生
难度: 中等查看答案及解析
-
室温下,下列溶液中粒子浓度关系正确的是
A.Na2S溶液:c(Na+) > c(HS-) > c(OH-) > c (H2S)
B.Na2C2O4溶液:c (OH-) = c(H+) + c(HC2O4-) + 2c (H2C2O4)
C.Na2CO3溶液:c (Na+) + c (H+) = 2c (CO32-) + c (OH-)
D.CH3COONa和CaCl2混合溶液: c (Na+) + c (Ca2+)=c (CH3COO-) +c (CH3COOH) +2c (Cl-)
难度: 中等查看答案及解析
-
对右图两种化合物的结构或性质描述正确的是
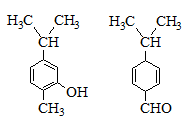
A.不是同分异构体
B.分子中共平面的碳原子数相同
C.均能与溴水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
难度: 中等查看答案及解析
-
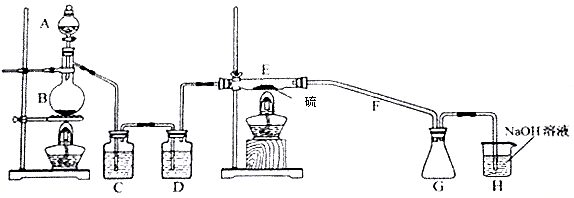
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
① 取少最样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;② 取少里样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为
A. Na2SO3、BaCO3 B. NaHCO3、Al(OH)3 C. AgCl、NaHCO3 D. Na2CO3、CuSO4
难度: 困难查看答案及解析
-
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
M(g)+N(g),所得实验数据如下表:
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量
/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是
A. 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡是,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
难度: 困难查看答案及解析
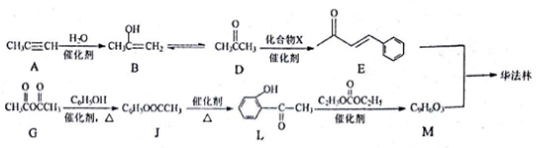
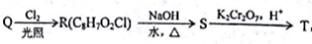 , T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。
, T的核磁共振氢谱只有两组峰,Q的结构简式为______, R→S的化学方程式为__________。