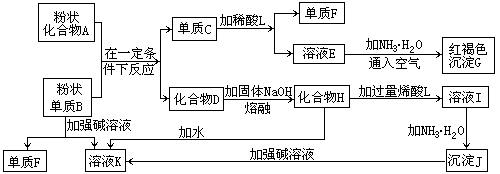
-
光纤通信70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成 ( )
A. 碳 B. 石英 C. 锗 D. 硅
难度: 简单查看答案及解析
-
北京在申办2008年奥运会时提出了"科技奥运、人文奥运、绿色奥运"的口号。为了把2008年北京奥运会办成“绿色奥运”,下列做法不可取的是 ( )
A.关闭所有化工厂 B.用天然气逐步取代民用燃煤
C.提高污水处理率 D.降低机动车辆尾气污染
难度: 简单查看答案及解析
-
某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为 [Al2(OH)nClm·yH2O]X ,式中m等于 ( )
A.3-n B.6-n C.6+n D.3+n
难度: 简单查看答案及解析
-
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是 ( )
A.Mg B.Cu C.Ag D.H2
难度: 简单查看答案及解析
-
四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种流体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是 ( )
A B C D
难度: 简单查看答案及解析
-
在PH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在的阴离子是
①Cl- ②NO3- ③SO42- ④S2-
A.①② B.②③ C.③④ D.①③。
难度: 简单查看答案及解析
-
某晶体水溶液中加入Fe2+的溶液,再加稀HNO3溶液立即变红,另取该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是
A、KSCN B、NH4SCN C、NH4Cl D、FeCl3
难度: 简单查看答案及解析
-
铁、镁、铝三种金属分别和同体积同浓度的盐酸反应,同温同压下,产生相同体积的氢气,则参加反应的金属
A、所失去的电子数相等 B、参加反应的金属质量相等
C、参加反应的金属物质的量相同 D、铁、镁、铝的质量比为28:12:9
难度: 简单查看答案及解析
-
0.1mol某元素的单质直接与氯气反应后,质量增加7.1g,这种元素是( )
A.Na B.Mg C.Fe D.Cu
难度: 简单查看答案及解析
-
下列块状金属在常温时能全部溶于足量浓HNO3的是 ( )
A.Ag B.Cu C.A1 D.Fe
难度: 简单查看答案及解析
-
下列物质的溶液中通入过量的CO2,有沉淀的是 ( )
A.CaCl2 B.NaAlO2 C.Ca(ClO)2 D.Na2SiO3
难度: 简单查看答案及解析
-
下列各组溶液,只要用试管和胶头滴管,不用任何试剂就可鉴别的是( )
A.KOH和Al2(SO4)3; B.H2SO4和Na2CO3;
C.CaCl2和Na2CO3; D.Ba(OH)2和NaHSO4。
难度: 简单查看答案及解析
-
NA为阿佛加德罗常数,下述正确的是 ( )
A.80g硝酸铵含有氮原子数为2NA
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
D.在铁与硫的反应中,1mol铁失去的电子数为2 NA
难度: 简单查看答案及解析
-
向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
A.NaCl Na2SO4 B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
难度: 简单查看答案及解析
-
如图所示,两个连通容器用活塞分开,左右两室各充入一 定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来 ( )
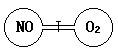
A.增大 B.减小 C.不变 D. 无法确定
难度: 简单查看答案及解析
-
某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 ( )
A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
难度: 简单查看答案及解析
-
能正确表示下列化学反应的离子方程式是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓。
D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
难度: 简单查看答案及解析
-
用浓硫酸吸收SO3可得到H2SO4·SO3,若用1.00克98%的硫酸溶液充分吸收SO3后,再进行稀释,可得到98%的硫酸质量为
A.1.98g B.2.00g C.2.22g D.2.42g
难度: 简单查看答案及解析