-
原子结构模型经历了五个主要阶段:1803年实心球模型→1897年葡萄干面包式模型→1911年原子核式结构模型→1913 的轨道模型→20 世纪初电子云的原子结构模型。对轨道模型贡献最大的科学家是
A. 玻尔 B. 汤姆生 C. 卢瑟福 D. 道尔顿
难度: 简单查看答案及解析
-
在通常条件下,下列各组物质的性质排列正确的是
A. Na、Mg、Al的第一电离能逐渐增大
B. 热稳定性:HF>H2O>NH3
C. S2﹣、Cl﹣、K+的半径逐渐增大
D. O、F、Ne的电负性逐渐增大
难度: 中等查看答案及解析
-
若某原子在基态时的价电子层排布为4d25s2,则下列说法正确的是( )
A. 该元素原子最外层共有4 个电子
B. 该元素原子核外第N 层上共有10 个不同运动状态的电子
C. 该元素处于第五周期IVA 族
D. 该元素原子第四电子层上有4 个空轨道
难度: 中等查看答案及解析
-
科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子数目及核电荷的数目有关。氩原子与硫离子的核外电子排布相同,都是1s22s22p63s23p6。下列说法正确的是
A. 两粒子的1s能级上电子的能量相同
B. 两粒子的3p能级上的电子离核的距离相同
C. 两粒子的电子发生跃迁时,产生的光谱不同
D. 两粒子都达8电子稳定结构,化学性质相同
难度: 困难查看答案及解析
-
下列电子排布式中,原子处于激发状态的是( )
A. 1s22s22p5 B. 1s22s22p43s2
C. 1s22s22p63s23p63d44s2 D. 1s22s22p63s23p63d34s2
难度: 简单查看答案及解析
-
氰气的分子式为(CN)2,结构式为N≡C—C≡N,性质与卤素相似,下列叙述正确的是( )
A. N≡C的键能小于C—C的键能 B. 分子中含有2个σ键和4个π键
C. N≡C 键的键长小于C≡C键的键长 D. 分子中只含有极性键
难度: 简单查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A. X与Y形成的化合物,X可以显负价,Y显正价
B. 第一电离能可能Y小于X
C. 气态氢化物的稳定性:HmY小于HmX
D. 最高价含氧酸的酸性:X对应的最高价含氧酸酸性弱于Y对应的最高价含氧酸的酸性
难度: 中等查看答案及解析
-
R为1~18号元素,其原子所具有的电子层数为最外层电子数的1/2,它可能形成的含氧酸根离子有:①R2O42-②RO42-,③R2O32-,④RO32-,下列叙述判断正确的是( )
A. 当它可以形成①时,可以形成③ B. 当它可以形成②时,可以形成③和④
C. 当它可以形成①时,不可能形成④ D. 当它形成②时,也可以形成①
难度: 中等查看答案及解析
-
A原子的结构示意图为
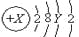 。则X、Y及该原子3p能级上的电子数分别为( )
。则X、Y及该原子3p能级上的电子数分别为( )A. 18、6、4 B. 20、8、6 C. 18、8、6 D. 15~20、3~8、1~6
难度: 中等查看答案及解析
-
现有四种元素的基态原子的核外电子排布式如下:
①1s22s22p63s2 ②1s22s22p63s23p1 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 最高正化合价:④>③>②>① D. 电负性:④>③>②>①
难度: 中等查看答案及解析
-
下列各元素,最易形成离子化合物的是( )
①第三周期第一电离能最小的元素 ②外围电子构型为2s22p6的原子 ③2p能级为半满的元素 ④电负性最大的元素
A. ①④ B. ③④ C. ②③ D. ①②
难度: 简单查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是( )
A. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C. 2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子
D. 最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A. K层电子数为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B. L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C. L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D. M层电子数为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
难度: 中等查看答案及解析
-
下列分子的电子式书写正确的是( )
A. 氮气
B. 过氧化氢 H+ [∶O∶]2- H+
C. 氨气
D. 二硫化碳 ∶S∶C∶S∶
难度: 简单查看答案及解析
-
下列事实不能用键能的大小来解释的是( )
A. N元素的电负性较大,但N2的化学性质很稳定 B. 卤族元素氢化物的稳定性逐渐减弱
C. 稀有气体一般难发生反应 D. O元素的电负性大于Cl,但Cl2比O2活泼性强
难度: 简单查看答案及解析