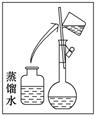
-
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图所示。做“硫酸的性质”的实验时,某同学取用Ba SO4溶液后,应把它放回的位置是

难度: 简单查看答案及解析
-
下列实验操作或装置正确的是
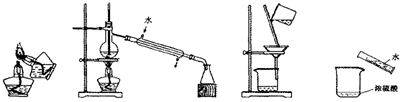
点燃酒精灯 蒸馏 过滤 稀释浓硫酸
A B C D
难度: 简单查看答案及解析
-
当光束通过鸡蛋清水溶液时,从侧面观察到一条光亮的“通路”,说明鸡蛋清水溶液是
A.溶液 B.胶体 C.悬浊液 D.乳浊液
难度: 简单查看答案及解析
-
2011年3月日本发生了特大地震灾害,卫生医疗队开赴前线展开救援,使用的下列消毒药品中属于强电解质的是
A.蔗糖 B.硫酸钡 C.碘酒 D.食醋
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是\
A.16 g CH4中含有4NA个C—H键
B.1 mol·L-1 NaCl溶液含有NA个Na+
C.1 mol Cu与足量稀硝酸反应产生NA个NO分子
D.常温常压下,22.4 L CO2中含有NA个CO2分子
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是:
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.含有0.1mol·L-1Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
难度: 简单查看答案及解析
-
配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是
A.称量时,将Na2CO3固体直接放在托盘天平的右盘上
B.将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
难度: 简单查看答案及解析
-
下列说法正确的是
A.1 molCl2含有6.02×1023个微粒
B.阿伏加德罗常数数值约等于6.02×1023
C.钠的摩尔质量等于它的相对原子质量
D.H2O的摩尔质量是18 g
难度: 简单查看答案及解析
-
下列离子方程式中,正确的是
A.钠和水反应:Na+2H2O = Na++2OH-+H2↑
B.铜跟稀硝酸反应:3Cu+ 8H++2NO3-=3Cu2++2NO↑+4H2O
C.氯气通入冷的氢氧化钠溶液中 2Cl2+2OH- = 3Cl-+ClO-+H2O
D.向AlCl3溶液中加入过量的氨水溶液:Al3+ + 3OH- = Al(OH)3↓
难度: 简单查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O。下列说法正确的是
A.该反应是非氧化还原反应
B.KNO3是还原剂
C.生成1mol K2FeO4转移的电子数为4 mol
D. K2FeO4不仅具有杀菌消毒作用,而且具有净水作用
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.乙酸的结构简式: C2H4O2
B.F-的结构示意图:
C.中子数为20的氯原子:1720Cl
D.NH3的电子式:
难度: 简单查看答案及解析
-
某溶液中存在大量的H+、Cl一、SO42一,该溶液中还可能大量存在的是
A.HCO3一 B.Ba2+ C.Al3+ D.Ag+
难度: 简单查看答案及解析
-
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3Cl2+6FeI2===2FeCl3+4FeI3
B.Cl2+FeI2===FeCl2+I2
C.Co2O3+6HCl===2CoCl2+Cl2↑+3H2O
D.2Fe3++2I-===2Fe2++I2
难度: 简单查看答案及解析
-
下列反应中,氧化剂与还原剂物质的量关系为1∶2的是
A.O3+2KI+H2O===2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2===2HClO+Ca(CH3COO)2
C.I2+2NaClO3===2NaIO3+Cl2
D.4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
难度: 简单查看答案及解析
-
在下列自然资源的开发利用中,不涉及化学变化的是
A.用蒸馏法淡化海水 B.用铁矿石冶炼铁
C.用石油裂解生产乙烯 D.用煤生产水煤气
难度: 简单查看答案及解析