-
“绿色化学”的核心是实现污染物“零排放”。下列最符合“绿色化学”理念的是
A. 在厂区大量植树绿化,净化污染的空气 B. 利用太阳能分解水制氢气
C. 将煤液化后使用以提高煤的利用率 D. 将化石燃料充分燃烧后再排放
难度: 简单查看答案及解析
-
宋代《本草图经》中,关于绿矾的分解有如下描述:“绿矾形似朴硝( Na2SO4·10H2O) 而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金计者是真也。”下列说法错误的是
A. “色赤”物质是Fe(OH)3 B. 流出的液体中可能含有硫酸
C. 可以通过焰色反应区分绿矾和朴硝 D. 绿矾分解过程中硫元素部分被还原
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 乙烯使酸性高锰酸钾溶液褪色是发生了加成反应
B. 乙烯、苯、乙酸分子中的所有原子都在同一平面上
C. C8H10属于芳香烃的同分异构体共有4 种
D. 蛋白质水解最终产物是氨基酸和甘油
难度: 中等查看答案及解析
-
W、X、Y、Z是四种短周期非金属元素,原于序数依次增大,X、Y原子核外L电子层的电子数之比为3:4,且Y的原子半径大于X的原子半径,X、Y、Z的最外层电子数之和为16,W的简单离子W-能与水反应生成单质W2。下列说法正确的是
A. 最简单氢化物的沸点:Z>X B. W与X形成的化合物中只有极性键
C. 最高价氧化物对应水化物酸性:Y>Z D. 阴离子的还原性:W>X
难度: 困难查看答案及解析
-
三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为
,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
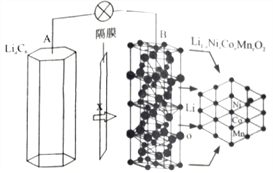
A. 允许离子X通过的隔膜属于阴离子交换膜
B. 充电时,A 为阴极,Li+被氧化
C. 可从无法充电的废旧电池的石墨电极中回收金属锂
D. 放电时,正极反应式为 Li1-aNixCoyMnzO2+aLi ++ae-= LiNixCoyMnzO2
难度: 困难查看答案及解析
-
NiS 可用作陶瓷和搪瓷的着色剂。NiS 在有水存在时能被氧气氧化成Ni(OH)S。将H2S通入稀硫酸酸化的NiSO4溶液中,经过过滤,制得NiS 沉淀,装置如图所示:
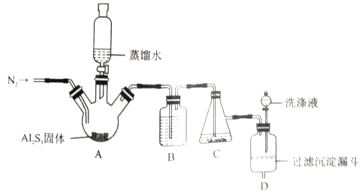
下列对实验的叙述正确的是
A. 在装置A中滴加蒸馏水前通入N2,是为了将H2S赶入C 装置中与NiSO4溶液反应
B. 装置B 中盛放浓硫酸
C. 装置D 中的洗涤液应用煮沸过的蒸馏水
D. 反应结束后继续通入N2 可将C装置中产生的沉淀压入过滤沉淀漏斗中
难度: 困难查看答案及解析
-
常温下,在新制氯水中滴加NaOH 溶液,溶液中水电离出来的c水(H+)的对数与NaOH 溶液体积之间的关系如图所示。下列推断正确的是

A. 用pH试纸测定E点对应的溶液,其pH=3
B. F、H点对应的溶液中都存在c(Na+)=c(Cl-)+c(ClO-)
C. 加水稀释H点对应的溶液,溶液的pH增大
D. G点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
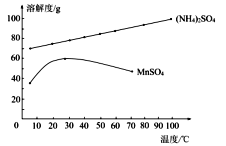
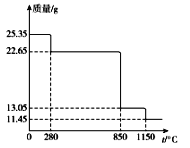
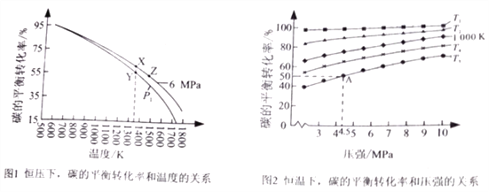
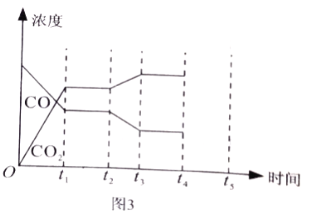

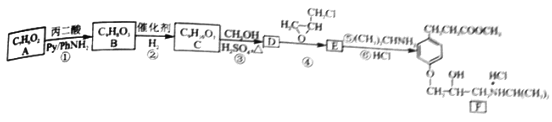

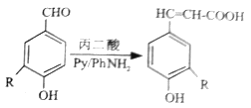
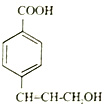 和
和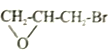 为主要原料合成制备
为主要原料合成制备 ,写出其合成路线_________。
,写出其合成路线_________。