-
下列化学用语表示正确的是
A. 羟基的电子式:
B. 乙酸的分子式:CH3COOH
C. 溴乙烷的结构简式:CH2BrCH2Br D. 乙炔的实验式:CH
难度: 简单查看答案及解析
-
下列关于石油、煤、天然气等化石能源的说法正确的是
A. 石油产品——直馏汽油和裂化汽油的成分相同
B. 获得上述化石能源的过程均为化学变化
C. 水煤气是通过煤的液化得到的气体燃料
D. 天然气是一种清洁能源
难度: 中等查看答案及解析
-
乙酸乙酯和丁酸互为同分异构体,下列方法中不能对二者进行鉴别的是
A. 利用金属钠 B. 利用质谱法 C. 利用红外光谱法 D. 利用核磁共振氢谱
难度: 中等查看答案及解析
-
下列化合物分子中的所有原子都处于同一平面的是
A. 溴苯 B. 乙醛 C. 四氯化碳 D. 丙烯
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 向蒸馏水中滴加浓硫酸的过程中,Kw保持不变
B. 酸与碱溶液恰好完全反应时所得溶液一定呈中性
C. 向醋酸钠溶液中加入少量冰醋酸,水的电离度减小
D. 广泛pH试纸能够测出溶液的精确pH
难度: 中等查看答案及解析
-
已知2H2O2(1)=2H2O(1)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是
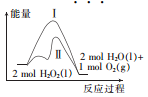
A. 该反应的△H<0,△S>0
B. 途径Ⅱ与途径I相比,可能是加了催化剂
C. 其他条件相同时,产生相同体积的氧气时放出的热量:途径I >途径Ⅱ
D. 其他条件相同时,产生相同体积的氧气所需的时间:途径I>途径Ⅱ
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 0.5mol C4H10中含有的共价键数为6.5NA
B. 3.4 g羟基和3.4 g氢氧根均含有2NA个电子
C. 1L0.1 mol·L-1CH3COOH溶液中含有的氧原子数为0.2NA
D. 标准状况下,22.4L由CHCl3和CH2Cl2组成的混合物中含有的分子数目为NA
难度: 中等查看答案及解析
-
下列反应的化学方程式书写及反应类型判断均正确的是
A. 甲烷与氯气反应:CH4+Cl2
CH3Cl+ HC1(加成反应)
B. 乙烯与水在一定条件下生成乙醇:CH2=CH2+H2O
 C3CH2OH(加成反应)
C3CH2OH(加成反应)C. 麦芽糖制葡萄糖:
+H2O
(氧化反应)
D. 乙醛与银氨溶液反应:CH3CHO+2Ag(NH3)2OH
CH3COONH4+3NH3+2Ag↓+H2O(取代反应)
难度: 中等查看答案及解析
-
T℃时,对于可逆反应:A(g)+B(g)
2C(g)+D(g) △H>0,下列各图中正确的是
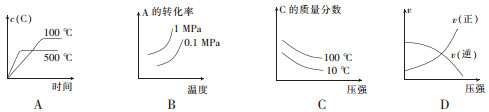
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
CH2=CH2与CH2=CR2(R为烃基)的混合物在一定条件下发生加聚反应,生成的产物有
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
下列有机物的命名错误的是
A.
1,2,4-三甲苯
B.
2,2,4,4一四甲基戊烷
C.
1,1-二乙基-1-丁醇
D.
1,3-二溴丙烷
难度: 简单查看答案及解析
-
下列实验现象与结论不一致的是
选项
实验操作
实验现象
结论
A
等体积等浓度的HA和HB两种酸分别与足量的锌反应,用排水法收集气体
HA放出氢气的反应速率更快
酸性:HB<HA
B
以铜、铁、浓硝酸构成原电池
铁表面有红棕色气泡产生
铜作原电池的负极
C
向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液
前者为黄色,后者为红褐色
升高温度,Fe3+的水解程度增大
D
将固体CaSO4加入Na2CO3饱和溶液中
一段时间后,检验固体主要成分为CaCO3
K sp ( CaSO4) < K sp ( CaCO3 )
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
某有机物的结构简式为
,下列说法正确的是
A. 该物质的分子式为C11H10O3 B. 该有机物含有4种官能团
C. 1 mol该有机物最多可以消耗2 mol NaOH D. 该有机物不能发生消去反应
难度: 中等查看答案及解析
-
已知常温下,HA的电离平衡常数Ka=6.25×10-5,H2CO3的电离平衡常数Ka1=4.17×10-7、Ka2=4. 90×10 -11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法不正确的是(不考虑饮料中其他成分)
A. 相同物质的量浓度的NaA、HA混合溶液呈碱性
B. 提高CO2兖气压力,碳酸饮料中c (A-)减小
C. 当碳酸饮料的pH为5.0时,
D. 碳酸饮料中各粒子的浓度关系为c( H+) =c( HCO3-)+2c( CO32-) +c(OH-) -c(HA)
难度: 困难查看答案及解析
-
下列实验操作与相应的现象或结论均正确的是
选项
实验操作
现象或结论
A
将铁屑、溴水、苯混合加热
制取溴苯
B
先加入浓硫酸,再加入苯,最后滴入浓硝酸
制取硝基苯
C
向C6H5ONa溶液巾通入CO2气体
溶液出现浑浊,证明酸性:C6H5OH<H2CO3
D
乙醇和浓硫酸混合加热,将产生的气体通人酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色,证明乙醇发生消去反应生成乙烯
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、W为醇、醛、羧酸、酯中的一种,它们之间存在如图所示的转化关系。下列判断正确的是
A. X是羧酸,Y是酯 B. Y是醛,W是醇 C. Z是醛,W是羧酸 D. X是醇,Z是酯
难度: 中等查看答案及解析
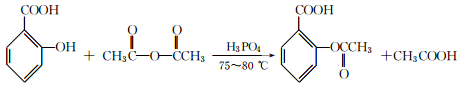
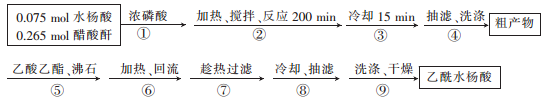

 )的一种同分异构体的结构简式_____________;
)的一种同分异构体的结构简式_____________;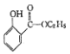 )的合成路线流程图(无机试剂任用),相关信息:
)的合成路线流程图(无机试剂任用),相关信息: 。
。