-
下列行为中不符合“促进低碳经济”宗旨的是 ( )
A.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
B.尽量使用含的产品,减少使用含
或
的产品
C.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气难度: 中等查看答案及解析
-
下列有关表述正确的是( )
A.HF的电子式:
B.硝基苯的结构简式:
C.质量数为37的氯原子:
D.乙醇分子比例模型: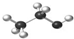
难度: 中等查看答案及解析
-
下列现象或事实解释正确的是( )
A.铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应
B.铝热反应需提供一定的能量引发,因为铝热反应为吸热反应
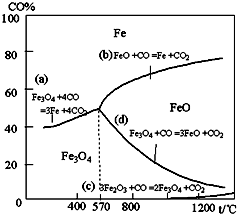
C.增加炼铁高炉的高度并不能提高CO的转化率,因为化学平衡没有移动Fe2O3+3CO2Fe+3CO2
D.鸡蛋清中加入2滴1%醋酸铅溶液后产生沉淀,因为蛋白质发生了盐析难度: 中等查看答案及解析
-
下列能达到实验目的是( )
A.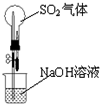
进行喷泉实验
B.
干燥HBr气体
C.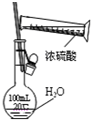
稀释浓硫酸
D.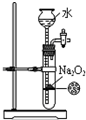
制备少量O2难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.生活中可以使用明矾对饮用水进行消毒、杀菌
B.高温能杀死H1N1流感病毒的原因是蛋白质受热变性
C.可用水鉴别苯、四氯化碳、乙醇三种无色液体
D.用灼烧闻气味的方法可区别纯棉织物和纯毛织物难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是( )
A.常温下在酸度AG=lg〔c(H+)/c(OH-)〕=10的溶液中:Fe2+、K+、NO3-、SO42-
B.能溶解NH4HCO3固体产生气泡的溶液中:AlO2-、HCO3-、Ba2+、NO3-
C.使甲基橙变红的溶液中:NH4+、Na+、SO42-、Cl-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、NH4+、SO42-、S2-难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
A.25℃时,pH=7的NH4Cl和NH3•H2O混合溶液中,OH-离子数为10-7 NA
B.标准状况下,NO和O2各11.2 L混合,所得混合气体的分子总数为0.75NA
C.14g分子通式为CnH2n的链烃中含有的C=C的数目为NA/n
D.两份2.7g铝分别与100mL浓度为2 mol•L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA难度: 中等查看答案及解析
-
新型解热镇痛抗炎药扑炎痛的结构如图所示,下列关于扑炎痛的叙述正确的是( )
A.该物质的分子式为C17H16NO5
B.该物质的核磁共振氢谱上共有9个峰
C.该物质与浓溴水反应生成白色沉淀
D.该物质在酸性条件下水解最终可以得到3种物质难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.用两个铜电极电解稀盐酸:2H++2Cl-H2↑+Cl2↑
B.将少量Ca(HCO3)2溶液中滴加过量的NaOH溶液中:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
D.向Na2FeO4溶液中加入稀硫酸产生Fe2(SO4)3:4FeO42-+20 H+=4Fe3++3O2↑+10H2O难度: 中等查看答案及解析
-
日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性.电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是( )
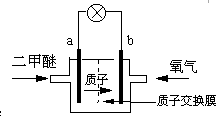
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.电池工作时,1mol二甲醚被氧化时就有6mol电子转移难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( )
A.四种元素的原子半径:C>D>B>A
B.最高价氧化物对应的水化物的酸性:D>B
C.C元素处于元素周期表中第3周期第ⅡA族
D.B、D的最高价氧化物中,B、D与氧原子之间均为单键难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系不正确的是( )
A.10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(H+)相等
B.25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH4+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c+c(Fe2+)=0.3 mol•L-1难度: 中等查看答案及解析
-
常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
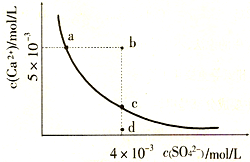
A.常温下CaS04饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp难度: 中等查看答案及解析
-
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)⇌xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是( )
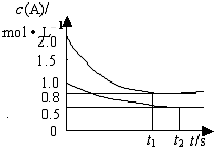
A.x等于1
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.7mol<n(B)<1.4mol难度: 中等查看答案及解析


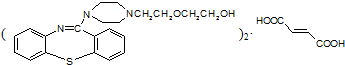 ,它的合成路线如下:
,它的合成路线如下: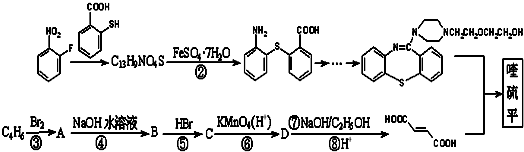
 (主产物);②合成过程中无机试剂任选,可以利用本题中相关信息.________.
(主产物);②合成过程中无机试剂任选,可以利用本题中相关信息.________. 
