-
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下:
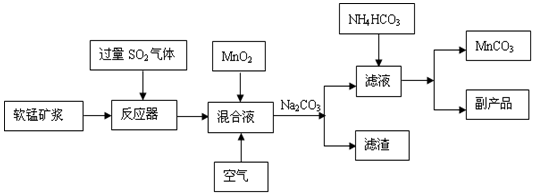
已知生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有________。
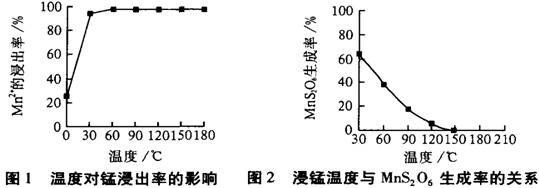
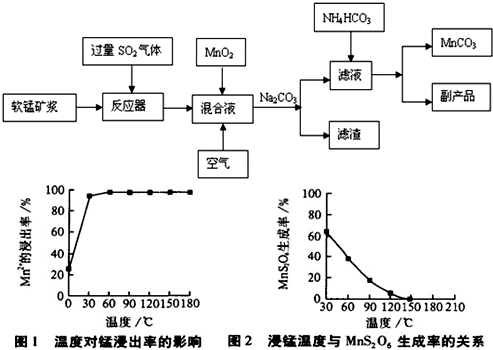
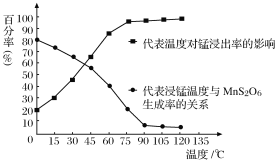
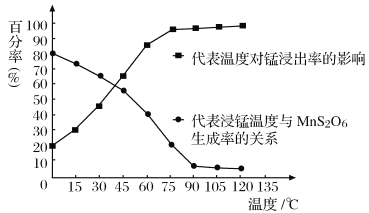
(2)由图可知,副反应MnSO4+ SO2  MnS2O6的△H________0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是________。
MnS2O6的△H________0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是________。
(3)步骤②中加入MnO2和通入空气的作用________。
(4)③中控制温度为60~70℃,温度不宜太高的原因是________。
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是________(写两点)。
-
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料.新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备.(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后过滤分离;
③调节滤液pH值为6.5~7.2,然后加入NH4HCO3,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰.
工业流程图如下:
已知生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有______.
(2)由图可知,副反应MnSO4+SO2 MnS2O6的△H______0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是______.
MnS2O6的△H______0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是______.
(3)步骤②中加入MnO2和通入空气的作用______.
(4)③中控制温度为60~70℃,温度不宜太高的原因是______.
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是______(写两点).
-
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料.新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备.(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后过滤分离;
③调节滤液pH值为6.5~7.2,然后加入NH4HCO3,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰.
工业流程图如下:

已知生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有______.
(2)由图可知,副反应MnSO4+SO2 MnS2O6的△H______0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是______.
MnS2O6的△H______0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是______.
(3)步骤②中加入MnO2和通入空气的作用______.
(4)③中控制温度为60~70℃,温度不宜太高的原因是______.
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是______(写两点).
-
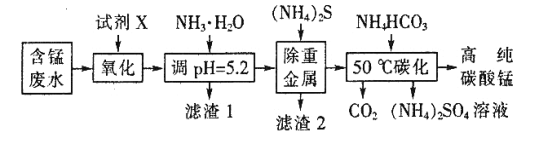
高纯碳酸锰(MnCO3)广泛应用于电子行业,制造高性能磁性材料。工业利用含锰废水(主要含Mn2+、 、H+、Fe2+、Al3+、Cu2+)制备碳酸锰、回收硫酸铵的工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)制备碳酸锰、回收硫酸铵的工艺流程如下:
已知某些物质完全沉淀的pH值如表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的pH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)试剂X是___________ (填标号)。
a.Cl2 b.MnO2 c.浓HNO3 d.H2O2
(2)“滤渣1”中主要成分的化学式为__________。
(3)“除重金属”时发生反应的离子方程式是______;反应中使用(NH4)2S而不使用Na2S的原因是________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_____,反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4,加入稍过量的NH4HCO3的目的是______使MnCO3沉淀完全,溶液的pH不能过低的原因是_____。
(5)由 MnCO3可制得重要的催化剂MnO2,2MnCO3+O2=2MnO2+2CO2。现在空气中加热460.0g的MnCO3,得到332.0g产品,若产品中杂质只有MnO,则该产品MnO2的质量分数是___________。
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工艺流程如下:( )
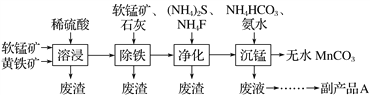
已知:净化工序的目的是除去溶液中的Ca2+、Cu2+等杂质(CaF2难溶)。
下列说法不正确的是
A. 研磨矿石、适当升高温度均可提高溶浸工序中原料的浸出率
B. 除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,发生的反应为MnO2+2Fe2++4H+===2Fe3++Mn2++2H2O
C. 副产品A的化学式(NH4)2S
D. 从沉锰工序中得到纯净MnCO3的操作方法是过滤、洗涤、干燥
-
Ⅰ.工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
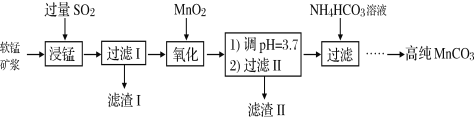
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O
ⅱ:____________________________________________(离子方程式)。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____________(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
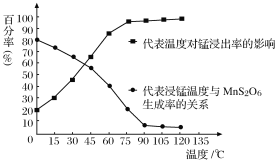
(4) “浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
(5).加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______________________________________________________。
Ⅱ.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室用如图装置模拟处理含Cr2O72-废水,阳极反应式Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。
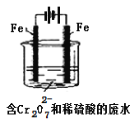
(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”),理由是______________________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________________________。
-
【选修2:化学与技术】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: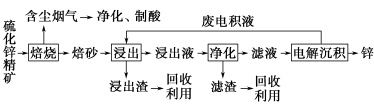
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的____________________操作。
(3)浸出液“净化”过程中加入的主要物质为___________ ,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________。
-
【化学选修2:化学与技术】
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某硫化锌精矿的主要成分为ZnS(含少量少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: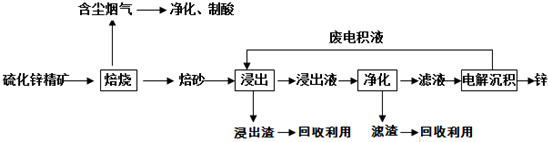
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为_______;
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作;
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是___________,反应的离子方程式为__________;
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是______;
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质.“氧压酸浸”中发生的主要反应的离子方程式为__________;
(6)硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS).请用简短的语言解释该反应发生的原理____________________________;
(7)我国古代曾采用“火法”工艺冶炼锌.明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,…,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”该炼锌工艺过程主要反应的化学方程式为____________________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
-
工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
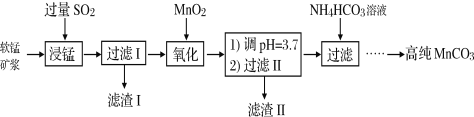
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O ⅱ: ......
写出ⅱ的离子方程式:____________________________________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_______(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_____________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________________________。
-
工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
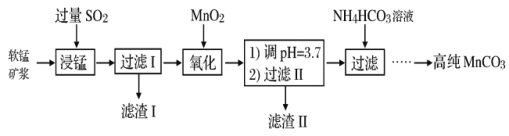
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
i.Fe2O3+6H+=2Fe3++3H2O ii.……
写出ii的离子方程式:______________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___________(填离子符号)
(3)氧化过程中被MnO2氧化的物质有(写化学式):______________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对浸锰”反应的影响如图所示:为减少MnS2O6的生成,“浸锰”的适宜温度是___________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:______________________。
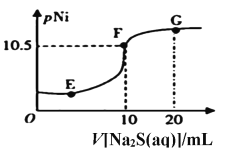
(6)已知:pNi=-lgc(Ni2+),常温下,Ksp(NiCO3)=1.4×10-7,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,会产生NiS沉淀,在滴加过程中pNi与Na2S溶液体积的关系如图所示。则在E、F、G三点中,___________点对应溶液中水电离程度最小,常温下,在NiS和NiCO3的浊液中 =______________________。
=______________________。