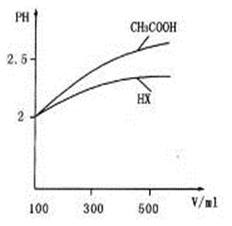
-
下列电离方程式的书写正确的是
A.2H2O = H3O++OH- B.NaHCO3 = Na++H++CO32-
C.NaHSO4 = Na++H++SO42- D.H2S
2H++S2-
难度: 中等查看答案及解析
-
下列事实中,不
能用勒沙特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.在FeSO4
溶液中加入少量铁粉以防止Fe2+被氧化
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.增大反应物浓度,平衡正向移动,反应物的转化率一定增大
B.正、逆反应速率改变时,平衡一定发生移动
C.对于任何可逆反应,使用催化剂只改变反应速率,不影响平衡
D.增大体系压强,化学反应速率加快,化学平衡一定正向移动
难度: 中等查看答案及解析
-
下列溶液中一定呈中性的是
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6mol·L-1的溶液
C.能够与Na反应生成H2的溶液
D.电解食盐水最后所得溶液
难度: 中等查看答案及解析
-
分析下面的能量变化示意图,确定下列热化学方程式正确的是
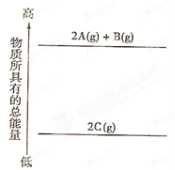
A.2A(g)+B(g)=2C(g);△H<0
B.2A(g)+B(g)=2C(g);△H>0
C.2A+B=2C;△H<0
D.2C=2A+B;△H<0
难度: 中等查看答案及解析
-
沼气的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量。下列热化学方程式中,正确的是
A.2CH4(g)+4O2(g) = 2CO2(g)+4H2O(l) △H=+890kJ/mol
B.CH4(g)+2O2(g) = CO2(g)+2H2O(g) △H=-890kJ/mol
C.CH4(g)+2O2(g) = CO2(g)+2H2O(l) △H=-890kJ/mol
D.1/2 CH4(g)+O2(g) = 1/2CO2(g)+H2O(g) △H=-445kJ/mol
难度: 中等查看答案及解析
-
下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
难度: 中等查看答案及解析
-
对已达化学平衡的下列反应:2X(g)+Y(g)
2Z(g)减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.
正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
一定条件下,恒容的密闭容器中存在反应:2A(g)+B(s)
2C(g) △H<0。下列描述中能证明上述反应已达平衡状态的是
A.摩尔质量:A<C
B.容器中混合气体的密度不随时间而变化
C容器中的气体压强不随时间而变化
D.容器中A与C的物质的量之比等于1:1
难度: 中等查看答案及解析
-
下列说法正确的是
A. Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
B. pH=2与pH=1的硝酸中c(H+)之比为1:10
C. 0.2 mol•L-1与0.1mol/L醋酸中c(H+)之比为2:1
D. 相同体积的0.1 mol•L-1盐酸和0.1mol/L醋酸分别与足量镁条反应,放出H2的体积比大于1:1
难度: 中等查看答案及解析
-
下列叙述正确的是
A.醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.25℃l.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
C.lmlpH=1的盐酸与10mLNaOH溶液混合后pH=7,则NaOH溶液的pH=11
D.pH=1的盐酸溶液稀释100倍后,pH=3
难度: 中等查看答案及解析
-
将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)
2Z(g);ΔH<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是
选择
改变的条件
正、逆反应速率变化
新平衡和原平衡比较
A
升高温度
逆反应速率增大量大于正反应速率增大量
Z的体积分数变大
B
增大压强
正反应速率增大,逆反应速率减小
Z的浓度不变
C
减小压强
正、逆反应速率都减小
Y的体积分数
变大
D
充入少量Z
逆反应速率增大
X的体积分数不变
难度: 困难查看答案及解析
-
某可逆反应L(s)+G(g)
3R(g); △H >0,下图表示温度、压强的变化对上述反应的影响。试判断图中y轴可以表示
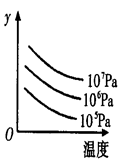
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
难度: 困难查看答案及解析
-
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是
A.相同温度下两种溶液的pH:Na2CO3>NaHCO3
B.若分别升高温度,两种溶液的pH均减小
C.若分别加入少量NaOH,两溶液中c(CO32-)均增大
D.两溶液中的离子浓度均存在关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
难度: 中等查看答案及解析
-
2011年9月29日,我国成功发射“天宫一号”,为将来建立空间站作准备。下图是空间能量转化系统的局部示意图,其中该燃料电池采用KOH溶液为电解质溶液,下列有关说法不正确的是
光电转换器→水电解系统→氢氧储罐→燃料电池系统
A.该能量转化系统中的水是可以循环的
B.燃料电池系统产生的能量实际上来自于太阳能
C.水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑
D.燃料电池放电时的正极反应:H2-2e-+2OH-=2H2O
难度: 中等查看答案及解析
-
全钒液流电池是一种新型的绿色环保储能电池,该电池性能优良,其电池总反应为:v3++VO2++H2O
VO2++2H++V2+。下列叙述正确的是
A.充电时阳极附近溶液的酸性减弱
B.充电时阳极反应式为:VO2++2H++e-=VO2++H2O
C.放电过程中电解质溶液中阳离子移向负极
D.放电时每转移1mol电子,负极有1mol V2+被氧化
难度: 困难查看答案及解析
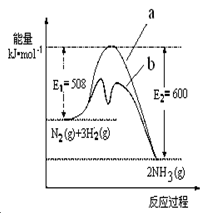
 1/2CH3OH(g) △H=-45.4kJ·mol-1。
1/2CH3OH(g) △H=-45.4kJ·mol-1。