-
下列做法不正确的是
A.易燃试剂与强氧化性试剂分开放置并远离火源
B.用湿润的红色石蕊试纸检验氨气
C.在50mL量筒中配制0.1000mol·L-1碳酸钠溶液
D.金属钠着火时,用细沙覆盖灭火
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA
C.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 NA
D.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.硫酸铝溶液中加入过量氨水 Al3++3OH-= Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2 +CO32-= CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-= ClO-+Cl-+H2O
D.稀硫酸中加入铁粉 2Fe+6H+= 2Fe3++3H2↑
难度: 中等查看答案及解析
-
下列实验能达到目的的是
A.用溴水鉴别苯和己烷
B.用BaCl2溶液鉴别SO42-和SO32-
C.用浓HNO3与Cu 反应制备NO2
D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl
难度: 中等查看答案及解析
-
对下列反应①KHCO3溶液与石灰水反应、②Na2SO3溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是
A. ①②③ B. ①②④ C. ①③④ D. ②③④
难度: 中等查看答案及解析
-
下表中所示物质或概念间的从属关系符合下图的是
X Y Z
A 钠元素 主族元素 短周期元素
B 氢氧化铁(固体) 胶体 分散系
C 电解质 化合物 纯净物
D 置换反应 氧化还原反应 放热反应
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.用KIO3 氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH-
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH-
NH3↑+H2O
C.将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O
难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数的值,下列叙述正确的是
A.常温下 ,4gCH4 含有NA 个C-H共价键
B.1 mol Fe 与足量的稀HNO3 反应,转移2 NA 个电子
C.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
难度: 中等查看答案及解析
-
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
A.K+、Na+、Br-、SiO32- B.K+、Na+、Cl-、NO3-
C.H+、Fe2+、SO42-、Cl2 D.K+、Ag+、NH3·H2O、NO3-
难度: 中等查看答案及解析
-
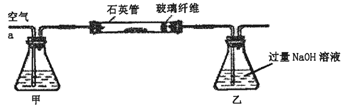
下列试验中,所选装置不合理的是
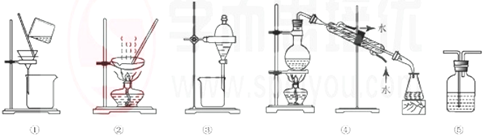
A.粗盐提纯,选①和②
B.用CC14提取碘水中的碘,选③
C.分离Na2CO3溶液和CH3COOC2H5,选④
D.用FeC12溶液吸收C12选⑤
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的数值,下列说法中正确的是。
A.1 mol Al3+含有的核外电子数为3NA
B.1 mol Cl2与足量的铁反应,转移的电子数为3NA
C.10 L pH=1的硫酸溶液中含有的H+数为2NA
D.10 L pH=13的NaOH溶液中含有的OH-数为NA
难度: 中等查看答案及解析
-
下列由相关实验现象所推出的结论正确的是
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
难度: 中等查看答案及解析
-
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2 下列说法正确的是
A.Cu2S既是氧化产物又是还原产物
B.每生成1 molCu2S,有4mol硫被氧化
C.CuFeS2仅作还原剂,硫元素被氧化
D.每转移1.2 mol电子,有0.2 mol硫被氧化
难度: 中等查看答案及解析
-
在常压和500℃条件下,等物质的量的Ag2O、Fe(OH)3、NH4HCO3、NaHCO3完全分解,所得气体体积依次为V1、V2、V3、V4,体积大小顺序正确的是
A.V3>V2 >V4 >V1 B.V3>V4 >V2 >V1
C.V3>V2 >V1 >V4 D.V2>V3 >V1 >V4
难度: 中等查看答案及解析
-
已知SO32-的还原性大于I-,某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍无色,则下列关于溶液组成的判断正确的是
① 肯定不含I- ② 肯定不含Cu2+ ③ 肯定含有SO32- ④ 可能含有I-
A.① ③ B.① ② ③ C.③ ④ D.② ③ ④
难度: 中等查看答案及解析
-
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,
则下列有关说法中不正确的是

A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色
难度: 中等查看答案及解析
-
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
选项
化合物 A B C D
Y Cu2S Fe2O3 C2H5OH FeCl3
W Cu Al2O3 C2H5ONa CuCl2
难度: 中等查看答案及解析
-
能实现下列物质间直接转化的元素是
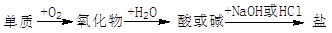
A. 硅 B. 硫 C. 铜 D. 铁
难度: 中等查看答案及解析
-
某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是
A.Na+和NO3-来自同一工厂 B.Cl-和NO3-一定来自同一工厂
C.Ag+和Na+可能来自同一工厂 D.SO42-和OH-一定来自同一工厂
难度: 中等查看答案及解析
-
v L Fe2(SO4)3溶液中含有a g SO42-,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解NaOH的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
(5)在下列配制0.5 mol·L-1 NaOH溶液过程示意图中有错误的是(填序号)______。
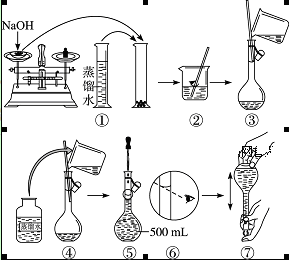
难度: 中等查看答案及解析
-
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。
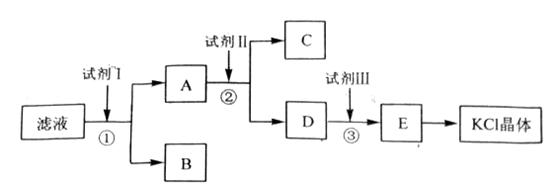
回答下列问题:
(1)起始滤液的pH_____7(填“大于”“小于”或“等于”),其原因是______________________________;(用离子方程式表示)
(2)试剂Ⅰ的化学式为___________,①中发生反应的离子方程式为_______________;
(3)试剂Ⅱ的化学式为____________,②中加入试剂Ⅱ的目的是__________________;
(4)试剂Ⅲ的名称是_____________,③中发生反应的离子方程式为________________;
难度: 困难查看答案及解析
-
食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水分、空气中的氧气以及光照、受热而引起的,已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O KI+I2
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。① 加KSCN溶液显红色,该试液中含有的物质是________(用离子符号表示);CCl4中显示紫红色的物质是________(用电子式表示)。
② 第二份试液中加入足量KI固体后,反应的离子方程式为_______________________。
(2)将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?(填“是”或“否”),并说明理由:________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
难度: 困难查看答案及解析