-
下列物质的化学用语正确的是( )
A.甲烷分子的球棍模型:

B.CO2的电子式
C.葡萄糖的最简式:CH2O
D.S2-的离子结构示意图:
难度: 中等查看答案及解析
-
下列大小顺序排列完全正确的组合是( )
①气态氢化物的稳定性:HF>NH3>PH3
②沸点:CH4>C3H8>CH3OH
③离子半径:K+>Ca2+>S2-
④相同温度、相同浓度溶液中水的电离程度:NH4Cl>CH3COOH>HCl
A.①② B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的数值。下列有关叙述正确的是( )
A.50℃时,pH=1的1.0L H2SO4溶液中含有的H+数目为0.1 NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的氢原子数目为1.5NA
D.3.4gNH3中含N—H键数目为0.2NA
难度: 中等查看答案及解析
-
下列有关物质分类或归纳的说法中,正确的一组是( )
①蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体
②聚乙烯、聚氯乙烯、纤维素都属于合成高分子
③明矾、石膏、冰醋酸、水都是电解质
④盐酸、漂白粉、水玻璃都是混合物
⑤分馏、干馏、裂化都是化学变化
⑥植物油、直馏汽油都可与溴水反应
A.①③⑤ B.②④⑥ C.①③④ D.②⑤⑥
难度: 中等查看答案及解析
-
某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有(不考虑顺反异构)( )
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Cu2+、Fe3+、Zn2+的氧化性依次减弱
难度: 中等查看答案及解析
-
下列事实不能用金属活动性解释的是( )
A.镀锌铁制品破损后,镀层仍能保护铁制品
B.工业上常用热还原法冶炼铁,用电解法冶炼钠
C.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部
D.生活中可用铝制的水壶烧水
难度: 中等查看答案及解析
-
8gA和17gB混合,在某温度时汽化,气体体积为480mL,若在相同条件下汽化2gA和7gB的混合物,则汽化后的体积为160mL,则A、B可能为下列哪组物质( )
A.C2H4、C2H2 B.C2H4、CH3OH
C.C2H2、C6H6 D.CH2O、CH3COOH
难度: 中等查看答案及解析
-
化学中常用图象直观地描述化学反应的进程或结果。下列图象描述正确的是( )
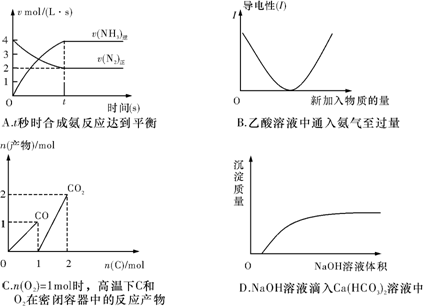
难度: 中等查看答案及解析
-
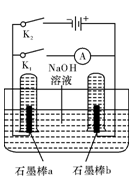
图中,Z为浸透饱和食盐水和酚酞试液的滤纸,水槽中盛有足量CuSO4溶液,X、Y为石墨电极。接通电路后,发现Z上的d点显红色。下列说法正确的是( )

A.接通电路后,水槽中溶液的pH不变
B.b是正极,Y电极上发生氧化反应
C.同温同压下,X、Y两电极上产生气体的体积相等
D.d点显红色是因为接通电路后OH-向d点移动
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.明矾溶液与氢氧化钡溶液反应,使SO恰好完全沉淀:Al3++2SO+2Ba2++3OH-===2BaSO4↓+Al(OH)3↓
B.向FeBr2溶液中通入过量氯气:2Fe2++Cl2===2Fe3++2Cl-
C.用铂电极电解MgCl2溶液时发生的反应:2Cl-+2H2OCl2↑+H2↑+2OH-
D.常温下将硝酸铵溶液与KOH溶液混合:NH+OH-===NH3·H2O
难度: 中等查看答案及解析
-
已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、y的值为( )
A.1.5,6.5 B.2,8 C.5,21 D.3,13
难度: 中等查看答案及解析
-
某溶液中只可能含有下列离子中的几种:K+、NH、NO、SO、SO、CO,取200mL该溶液分成两等份,进行以下实验:
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。
(2)第二份先加足量的盐酸无现象,现加足量的BaCl2得到2.33g固体,则该溶液中( )
A.可能含有K+、CO B.一定含有K+且c(K+)≥0. 1mol/L
C.一定不含有NO D.肯定含有NO、SO、NH
难度: 中等查看答案及解析
-
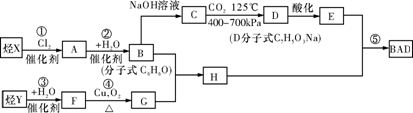
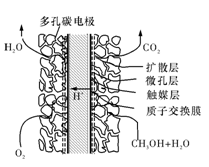
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示,下列关于固体燃料电池的有关说法正确的是( )

A.电极b为电池负极,电极反应式为O2+4e-===4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-===2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-===2CO2+2H2O
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO===4Mg2++NH+3H2O
B.25℃时,将20mL 0.1mol·L-1H2SO4溶液和30mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11
C.将10mL 0.1mol·L-1KAl(SO4)2溶液和10mL 0.2mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1∶2
D.浓度均为0.1mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
难度: 中等查看答案及解析
-
将Fe和Cu的混合粉末ag加入到100mL 4mol/L稀硝酸中充分反应后(假设还原产物只有NO),下列说法正确的是( )
A.若反应后有Cu剩余,则反应后溶液中含有的金属阳离子一定是Cu2+
B.若反应后的溶液中有Cu2+,则反应后溶液中含有的金属阳离子一定是Fe2+、Fe3+
C.若反应后的溶液中无金属剩余,则加入金属粉末质量8.4g<a<9.6g
D.若加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属粉末质量最小为7.2g
难度: 中等查看答案及解析